用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.4.2g聚乙烯中含有的碳原子数目为0.3NA |
| B.25℃时,pH=1的H2SO4溶液中含有的H+数目为0.1NA |
| C.7.8gNa2O2与足量的水反应,转移的电子总数为0.2NA |
| D.在有浓硫酸并加热的条件下,1mol乙酸和1mol乙醇充分反应最后生成NA个乙酸乙酯分子 |
两体积相同的密闭容器中均充入1 mol X和1mol Y,分别于300℃和500℃开始发生反应: X(g)+Y(g)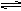 3Z(g)。Z的含量(Z%)随时间t的变化如下图所示。已知在t3时刻改变了某一实验条件。下列判断正确的是
3Z(g)。Z的含量(Z%)随时间t的变化如下图所示。已知在t3时刻改变了某一实验条件。下列判断正确的是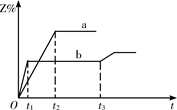
| A.曲线a是500℃时的图像 |
| B.正反应是吸热反应 |
| C.t3时刻可能是增大了压强 |
| D.t3时刻可能是降低了温度 |
下列说法正确的是
| A.2 mol/L KCl溶液与1 mol/L K2SO4溶液混合后,c(K+)为2 mol/L |
| B.120 g NaCl溶液中溶有20 g NaCl,该温度下NaCl的溶解度为20g |
| C.22.4 L HCl气体溶于水制成1 L溶液,该溶液的物质的量浓度为1 mo1/L |
| D.把5 g胆矾(CuSO4∙5H2O)溶于45 g水中,所得溶液溶质的质量分数为10% |
氨气溶于水得到氨水,氯气溶于水得到氯水,下列关于新制的氨水、氯水的描述正确的是
| A.“两水”都是混合物,溶液中含有的粒子种类、数目相同 |
| B.“两水”中都存在可逆反应的化学平衡和弱电解质的电离平衡 |
| C.“两水”都有刺激性气味,都能漂白有机色素 |
| D.“两水”放置时间较久后都会因为相同的原理而变质 |
原电池与电解池在生活和生产中有着广泛应用。下列有关判断中错误的是
装置①装置②装置③
| A.装置①研究的是金属的吸氧腐蚀,Fe上的反应为Fe-2e = Fe2+ |
| B.装置②研究的是电解CuCl2溶液,它将电能转化为化学能 |
| C.装置③研究的是电解饱和食盐水,电解过程中,B极上发生氧化反应 |
| D.三个装置中涉及的主要反应都是氧化还原反应 |
为验证铜与稀硝酸反应的还原产物是NO而不是NO2,设计了如下图的装置,以下叙述错误的是
| A.应先打开活塞再从右侧加稀硝酸 |
| B.左侧稀硝酸须注满 |
| C.关闭活塞后铜丝会全部溶解 |
| D.反应停止后打开活塞气体变成红棕色 |