A、B、C、D、E、F六种物质,一定条件下有如下图所示的转化关系(所有的反应物和生成物均已给出):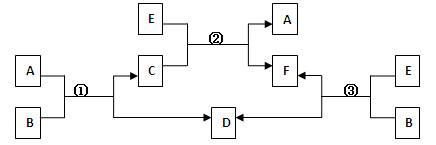
(1)若①、②、③均为水溶液中的置换反应,且A、D、E是常见的卤素单质,B、C、F为化合物。则A、D、E的氧化性由强到弱的顺序为 (用字母表示),其中A的化学式为 (用元素符号表示)。
(2)若B是一种淡黄色固体,绿色植物的呼吸作用和光合作用可实现自然界中D和E的循环,则F的化学式为 ;反应①的离子方程式是 。
(3)若B是水,C是一种有磁性的化合物,E是一种无色、无味的有毒气体,则反应①的化学方程式是 ;反应③是某些氮肥厂获得合成氨原料D的一个重要反应,假设反应后的气体中只有F和D,从综合经济效益的角度考虑,简述如何从反应后的混合物中分离出D。 。
某学习小组探究溴乙烷的消去反应并验证产物。
实验原理:CH3CH2Br + NaOH  CH2=CH2↑ + NaBr + H2O
CH2=CH2↑ + NaBr + H2O
实验过程:组装如图1所示装置,
检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。
(1)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因:。
(2)丙同学认为只要对实验装置进行适当改进,即可避免对乙烯气体检验的干扰,改进方法:。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(3)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是,此时发生反应的化学方程式为: 。
(4)结合资料二、三,你认为还应该在实验装置中增加的两种仪器是①。 ②。
绿原酸是一种新型高效的酚型天然抗氧化剂,在食品行业有着广泛的用途,在某些食品中可取代或部分取代目前常用的人工合成的抗氧化剂。
绿原酸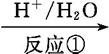
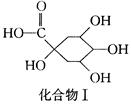 +
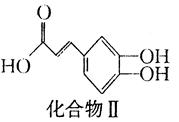
+
(1)在反应①中,绿原酸与水按1∶1发生反应,则绿原酸的分子式为
(2)1 mol化合物Ⅰ与足量金属钠反应生成标准状况下氢气体积为 。
(3)写出化合物Ⅱ与足量浓溴水反应的化学反应方程式: .
(4)1 mol化合物Ⅱ与足量的试剂X反应得到化合物Ⅲ(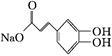 ),则试剂X是 。
),则试剂X是 。
(8分)工业上制备BaCl2的工艺流程图如下: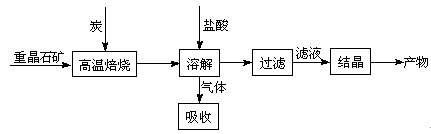
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)+4C(s)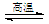 4CO(g)+BaS(s) DH1 = +571.2 kJ·mol-1 ①
4CO(g)+BaS(s) DH1 = +571.2 kJ·mol-1 ①
BaSO4(s)+2C(s)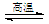 2CO2(g)+BaS(s) DH2= +226.2 kJ·mol-1 ②
2CO2(g)+BaS(s) DH2= +226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =。
=。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s)+CO2(g) 2CO(g)的DH2= kJ·mol-1。
2CO(g)的DH2= kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是
,。
(12分)已知A为蓝色溶液,B、C、I、K为单质,其余均为化合物,其中B、L、I、K 常温下为气体,且I为有色气体。G为黑色固体,F的焰色反应透过蓝色钻玻璃片显紫色,各物质转化关系如图。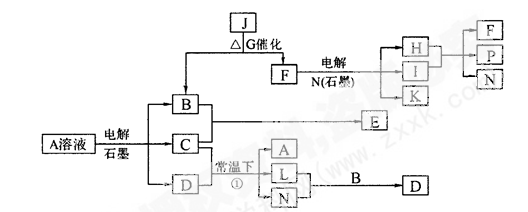
回答下列问题:
(1)P的电子式是_________________;
(2)C元素原子价电子排布式为:。
(3)已知B、H和C2H5OH能够组成燃料电池,写出该燃料电池的负极反应式:
_______________________________________________________________;
(4)A的水溶液呈___________(填“酸性”“碱性”“中性”),用离子方程式和必要的文字说明原因______________________________________________________________
(5)用惰性电极电解400.00 mL A溶液,一段时间内测得溶液pH=1,则需要向溶液中加入___________,其质量为______g,才能使溶液恢复到电解前的状态(不考虑溶液体积变化)。
(8分) X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:
①X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的化学式是____________。
(2)Z2Y2与X2Y反应的化学方程式是__________________________________。
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(Ⅰ)的电极名称是____________(填写“正极”或“负极”)。
C(Ⅱ)的电极反应式是__________________________________。
(4)铜屑放入稀硫酸不反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是__________________________________。