已知碳有两种常见的同位素12C、13C;氧也有常见的三种同位素18O、17O、16O。由这五种微粒构成的二氧化碳分子中,其相对分子质量最多可能有
A.6种 B.10种 C.11种 D.12种
常温下,下列三个反应均能发生:
X2+2W2+=2X-+2W3+ Z2+2X-=2Z-+X2 2W3++2Y-=2W2++Y2
则在相同条件下,下列三个反应也能发生的是()
①Y2+2X-=2Y-+X2②Z2+2Y-=2Z-+Y2③2W3++2Z-=2W2++Z2
| A.只有① | B.只有② | C.①和② | D.②和③ |
下列分类合理的是()
| A.CuSO4和CuSO4•5H2O都属于纯净物 |
| B.H2SO4和NaHSO4都属于酸 |
| C.液氯和氯水都属于混合物 |
| D.Na2O和Na2O2都属于碱性氧化物 |
臭氧是理想的烟气脱硝剂,其脱硝反应为: 2NO2(g)+O3(g)  N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
| A |
B |
C |
D |
 |
 |
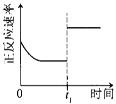 |
 |
| 升高温度,平衡常数减小 |
0~3s内,反应速率为:v(NO2)=0.2mol·L-1 |
t1时仅加入催化剂,平衡正向移动 |
到达平衡时,仅改变x,则x为c(O2) |
某学习小组为研究电化学原理,设计右图装置。下列叙述正确
| A.K与M、N均断开,一段时间后电解质溶液质量变大 |
| B.K分别与M、N相连时,铁均受到保护 |
| C.K与M相连时,每转移1mol电子Fe表面生成32gCu |
| D.K与N相连时,碳棒上产生使湿润的淀粉碘化钾试纸变蓝的气体 |
某温度下向容积为2 L的密闭反应器中充入0.10 mol SO3,当反应器中的压强不再变化时测得SO3的转化率为20%,则该温度下反应2SO2(g)+O2(g)  2SO3(g)的平衡常数
2SO3(g)的平衡常数
| A.1.6×103 | B.3.2×103 | C.8.0×102 | D.4.0×103 |