铁与HNO3 作用时,还原产物除与HNO3浓度有关外,还与温度有关。已知铁与冷的稀HNO3反应时,主要还原产物为NO气体;与热的稀HN03反应时,主要还原产物为N2O气体;当HNO3更稀时,其重要还原产物是NH4+。现有铁与稀 HNO3的作用,请分析下图,回答有关问题。
作用时,还原产物除与HNO3浓度有关外,还与温度有关。已知铁与冷的稀HNO3反应时,主要还原产物为NO气体;与热的稀HN03反应时,主要还原产物为N2O气体;当HNO3更稀时,其重要还原产物是NH4+。现有铁与稀 HNO3的作用,请分析下图,回答有关问题。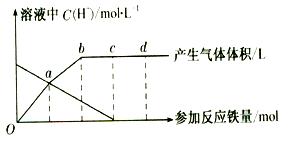
假设曲线的各段内只有一种还原产物,。
(1)0点到a点的还原产物是 。
(2)a点到b点的还原产物是__ __,其原因是 。
(3)试完成b点到c点的反应方程式:
口Fe+口HNO3——口Fe( NO3)3+口[ ]+口H20。
(4)反应过程中,到达 点时,HN03已完全反应。
(5)已知达到d点时反应结束,此时溶液中的主要阳离子是 。
( 6)c点和d点参加反应的铁的物质的量之比是 。
6)c点和d点参加反应的铁的物质的量之比是 。
北京时间2008年2月21日上午11时26分,美国用导弹击毁了失控的卫星。美方称,卫星坠落地面时,燃料罐中装有的约453 kg联氨(N2H4),可能发生泄漏,造成伤害。
(1)联氨是一种无色可燃的液体,溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式:。
(2)联氨(N2H4)是航天飞船常用的高能燃料。联氨可用氨和次氯酸钠按一定物质的量之比混合反应生成联氨、氯化钠和水;该反应的氧化产物是。也可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,写出其反应的化学方程式。
(3)火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热。已知:12.8 g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量;
H2O(l)=H2O (g) DH=+44 kJ·mol-1
2H2O2(l)=2H2O(l)+ O2(g)DH=–196.4 kJ·mol-1
则写出表示联氨燃烧热的热化学方程式为。
(A).【物质结构与性质】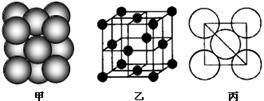
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| A |
|||||||||||||||||
| B |
C |
||||||||||||||||
| D |
E |
||||||||||||||||
试回答下列问题:
(1)请写出元素D的基态原子电子排布式;
(2)D、E两元素的部分电离能数据列于下表:
| 元素 |
D |
E |
|
| 电离能 /kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态D2+再失去一个电子比气态E2+再失去一个电子难。对此,你的解释是;
(3)A的氢化物的中心原子的杂化形式为;C在空气中燃烧产物的分子构型为,与其互为等电子体的单质的分子式为。
(4)B单质晶体中原子的堆积方式如右图甲所示,其晶胞特征如右图乙所示,原子之间相互位置关系的平面图如右图丙所示。晶胞中B原子的配位数为,一个晶胞中B原子的数目为。
(B).【实验化学】
牙膏是生活必需品。下面是牙膏中某些主要成分的检验流程图,。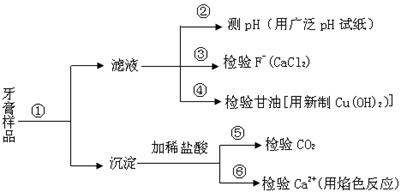
请回答下列问题:
(1)在①中加水、搅拌、静置后,接下来的实验操作名称是,所需要的主要玻璃仪器有。
(2)在②中用pH试纸测溶液的pH的操作方法是。
(3)写出④中发生反应的化学方程
式:。
(4)将⑤中放出的气体通入澄清的石灰水中时,未见沉淀出现,则可能的原因是、
(任答两条)。
(5)在⑥中检验Ca2+的存在,除可用焰色反应外,还可利用Ca2+和溶液的反应来进行。
A【物质结构与性质】纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。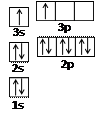 ⑴A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
⑴A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
①某同学根据上述信息,推断B的核外电子排布如右图所示,
该同学所画的电子排布图违背了。
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为。 ⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为。
③继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为。
B【实验化学】某化学研究性学习小组为测定果汁中Vc含量,设计并进行了以下实验。
Ⅰ 实验原理
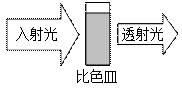
将特定频率的紫外光通过装有溶液的比色皿,一部分被吸收,通过对比入射光强度和透射光强度之间的关系可得到溶液的吸光度(用A表示,可由仪器自动获得)。吸光度A的大小与溶液中特定成分的浓度有关,杂质不产生干扰。溶液的pH对吸光度大小有一定影响。
Ⅱ 实验过程
⑴配制系列标准溶液。分别准确称量质量为1.0mg、1.5mg、2.0mg、2.5mg的标准Vc试剂,放在烧杯中溶解,加入适量的硫酸,再将溶液完全转移到100mL容量瓶中定容。
上述步骤中所用到的玻璃仪器除烧杯、容量瓶外还有。
⑵较正分光光度计并按顺序测定标准溶液的吸光度。为了减小实验的误差,实验中使用同一个比色皿进行实验,测定下一溶液时应对比色皿进行的操作是。测定标准溶液按浓度(填“由大到小”或“由小到大”)的顺序进行。
⑶准确移取10.00mL待测果汁样品到100mL容量瓶中,加入适量的硫酸,再加水定容制得待测液,测定待测液的吸光度。
Ⅲ 数据记录与处理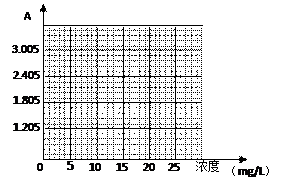 ⑷实验中记录到的标准溶液的吸光度与浓度的关系如下表所示,根据所给数据作出标准溶液的吸光度随浓度变化的曲线。
⑷实验中记录到的标准溶液的吸光度与浓度的关系如下表所示,根据所给数据作出标准溶液的吸光度随浓度变化的曲线。
| 标准试剂编号 |
① |
② |
③ |
④ |
待测液 |
| 浓度mg/L |
10 |
15 |
20 |
25 |
— |
| pH |
6 |
6 |
6 |
6 |
6 |
| 吸光度A |
1.205 |
1.805 |
2.405 |
3.005 |
2.165 |
⑸原果汁样品中Vc的浓度为mg/L
⑹实验结果与数据讨论
除使用同一个比色皿外,请再提出两个能使实验测定结果更加准确的条件控制方法。
过碳酸钠是一种有多用途的新型氧系漂白剂,化学式可表示为aNa2CO3·bH2O2。现将一定质量的过碳酸钠粉末溶于水配成稀溶液,再向其中加入适量MnO2粉末,充分反应后生成672mL气体(标准状况)。反应后的混合物经过滤、洗涤后,将滤液和洗涤液混合并加水配成100mL溶液A。现向三份体积为10mL、浓度为cmol/L的稀硫酸中分别逐滴滴入溶液A,边滴边振荡,充分反应后,测得实验数据如下表所示:
| 实验序号 |
Ⅰ |
Ⅱ |
Ⅲ |
| 滴加溶液A的体积/mL |
5.0 |
10.0 |
15.0 |
| 生成气体的体积/mL(标准状况) |
44.8 |
89.6 |
112 |
⑴稀硫酸的物质的量浓度c=mol/L。
⑵计算确定过碳酸钠的化学式。
⑶工业上常以所含活性氧的质量分数[w(活性氧)=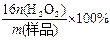 ]来衡量过碳酸钠产品的优劣,13%以上者为优等品。
]来衡量过碳酸钠产品的优劣,13%以上者为优等品。
现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗33.00mL,试计算判断该样品是否为优等品。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
有机物A(分子式C6H10O3)是合成某种隐形眼镜材料的单体,A可发生如下变化:
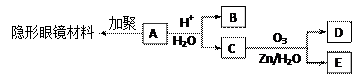 |
已知:Ⅰ.物质B是最简单的二元醇,可用作汽车发动机抗冻剂;物质D不能发生银镜反应,但能与NaHCO3溶液反应放出气体。
Ⅱ.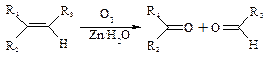
回答下列问题:
⑴隐形眼镜材料的结构简式为;
⑵写出物质B在铜催化下与O2反应的化学方程式;
⑶与C互为同分异构体,分子为链状的酯类物质共有种;
⑷请设计合理方案,用物质D制取乙二酸(其他无机原料自选,用反应流程图表示,并注明必要的反应条件)。
例如: