T℃时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图2所示:下列描述正确的是( )
| A.平衡时X、Y的转化率相同 |
| B.T℃时,若起始时X为0.71mol,Y为1.00 mol,则平衡时Y的转化率约为60% |
C.T℃时,该反应的化学方程式为:X(g)+Y(g)  2Z(g),平衡常数K=40 2Z(g),平衡常数K=40 |
| D.达到平衡后,将容器体积压缩为1 L,平衡向正反应方向移动 |
球墨铸铁中含有一种铁碳化合物X。实验室测定化台物X的组成实验如下:
下列说法不正确的是
| A.固体2是Fe2O3 |
| B.溶液甲中可能含有Fe3+ |
| C.X的化学式可以表示为Fe3C2 |
| D.X与足量的热浓硝酸反应有NO2和CO2生成 |
H2和I2在一定条件下能发生反应:H2(g)+I2(g) 2Hl(g)△H="-a" kJ/mol。已知:
2Hl(g)△H="-a" kJ/mol。已知: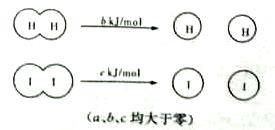
下列说法正确的是
| A.H2、I2和HI分子中的化学键都是非极性共价键 |
| B.断开2 mol Hl分子中的化学键所需能量约为(c+b+a))kJ |
| C.相同条件下,lmol H2(g)和lmol I2(g)总能量小于2 molHl(g)的总能量 |
| D.向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2a kJ |
某溶液中含有NH4+、SO32-、SiO32-、Br一、CO32-、.Na+,向该溶液中通入过量的Cl2,下列判断正确的是
①反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+
②有胶状物质生成
③有气体产生
④溶液颜色发生变化
⑤溶液中共发生了3个氧化还原反应
| A.①⑦③④ | B.①③③④⑤ | C.①③④⑤ | D.②④⑤ |
下列图示的实验操作,不能实现相应实验目的的是
| A.鉴别甲苯与己烷 |
B.研究浓度对Fe3++3SCN- Fe(SCN)3的影响 Fe(SCN)3的影响 |
 |
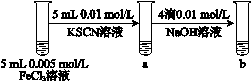 |
| C.检验CH3CH2OH与浓H2SO4加热至170℃的产物乙烯 |
D.比较碳酸钠与碳酸氢钠的热稳定性 |
 |
 |
下列推测或结论不合理的是
| A.X2-和Y+核外电子层结构相同,原子序数:X<Y |
| B.气态氢化物的稳定性HCl> HBr,还原性:Cl- >Br一 |
| C.硅、锗都位于金属与非金属的交界处,用途:都可以做半导体材料 |
| D.铷(37Rb)和锶(38Sr)分别位于第五周期lA和ll A族,碱性:RbOH>Sr(OH)2 |