在t℃下,某反应达到平衡,平衡常数K= 。恒容时,温度升高,NO浓度减小。下列说法正确的是
。恒容时,温度升高,NO浓度减小。下列说法正确的是
| A.该反应的焓变为正值 |
| B.K表达式中,C(SO3)指反应在该条件下达到化学平衡时SO3的物质的量浓度 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为:NO+SO3 NO2+SO2 NO2+SO2 |
醋酸溶液中存在电离平衡:CH3 COOHH++CH3 COO-,下列叙述不正确的是()
| A.CH3 COOH 溶液中离子浓度的关系满足:c(H+)= c(OH-)+c(CH3 COO-) |
B.0.1 mol ·L-1的CH3 COOH 溶液加水稀释,溶液 中c(OH-)减小 中c(OH-)减小 |
| C.CH3 COOH 溶液中加入少量CH3 COONa固体,平衡逆向移动 |
| D.常温下, pH=2的CH3 COOH 溶液与pH=12的NaOH 溶液等体积混合后,溶液的pH<7 |
在一定温度下的密闭容器中,加入1 mol CO和1 mol H2O发生反应:CO(g)+H2O(g) CO2(g)+H2(g),达到平衡时测得n(H2)为0.5mol,下列说法不正确的是()
CO2(g)+H2(g),达到平衡时测得n(H2)为0.5mol,下列说法不正确的是()
| A.在该温度下平衡常数K="1" | B.平衡常数与反应温度无关 |
| C.CO的转化率为50% | D.其他条件不变时,改变压强平衡不移动 |
已知短周期元素的离子。 都具有相同的电子层结构,则下列叙述正确的是()
都具有相同的电子层结构,则下列叙述正确的是()
| A.原子半径:A>B>C>D | B.原子序数:d>c>b>a |
| C.离子半径:C>D>B>A | D.单质的还原性:A>B>D>C |
在溶液中能大量共存的一组离子是()
A.强酸溶液中:K+、Fe2+、NO2-、SO |
B.Na+、CO32-、SO 、Fe3+ 、Fe3+ |
C.FeC12溶液中:K +、Na+、SO 、A1O2- 、A1O2- |
D.Na+、CH3COO—、CO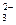 、NH4+ 、NH4+ |
能正确表示下列反应的离子方程式的是()
A.足量硫 酸铝溶液与纯碱反应:2Al3++3CO 酸铝溶液与纯碱反应:2Al3++3CO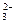 +3H2O = 2Al(OH)3 ↓+3CO2↑ +3H2O = 2Al(OH)3 ↓+3CO2↑ |
B.碳酸氢钠溶液与少量石灰水反应:HCO3- +Ca2++OH-=CaCO3↓+H2O +Ca2++OH-=CaCO3↓+H2O |
C.苯酚与碳酸钠溶液反应:2C6 H5 OH+CO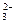 = 2C6 H5 O-+CO2 ↑+H2O = 2C6 H5 O-+CO2 ↑+H2O |
D.碳酸钡与硫酸溶液反应:Ba2++SO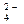 = BaSO4↓ = BaSO4↓ |