在酸性溶液中能大量共存,并且溶液为无色透明的离子组是
| A.Na+、K+、SiO32-、SO42- | B.NH4+、Na+、NO3-、Cl- |
| C.K+、Ca2+、HCO3-、Cl- | D.Mg2+、K+、Cl-、MnO4― |
某溶液可能含有Cl—、SO42—、CO32—、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液加热,得到0.02mol气体,同时产生红褐色沉淀;过滤洗涤、灼烧至恒重,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
| A.至少存在5种离子 | B.Cl-一定存在,且c(Cl—)≥0.4mol/L |
| C.SO42—、NH4+一定存在,Cl—可能不存在 | D.CO32—、Al3+一定不存在,K+可能存在 |
实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示)。已知固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种。若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是
| A.只用一种试剂就可以确定该固体M的具体成分 |
| B.往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3 |
| C.往溶液中加入稀硝酸酸化的BaCl2,若有白色沉淀,则固体M为Na2SO4 |
| D.用pH试纸检验,若pH=7,则固体M一定是Na2SO4 |
将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如右图所示。则下列说法不正确的是
| A.镁和铝的总质量为9 g |
| B.最初20 mLNaOH溶液用于中和过量的硫酸 |
| C.硫酸的物质的量浓度为2.5 mol·L-1 |
| D.生成的氢气在标准状况下的体积为11.2 L |
一定温度下,m g下列物质在足量的氧气中充分燃烧后,产物与足量的过氧化钠完全反应,过氧化钠增质量加了n g,且n>m,符合此要求的物质是
①H2②CO ③CO和H2的混合物 ④HCOOH ⑤CH3CHO
| A.①②③ | B.⑤ | C.④ | D.①②③④ |
现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如下: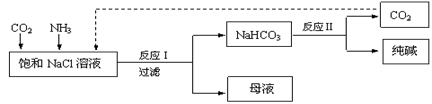
有关说法错误的是
| A.反应Ⅰ原理为CO2 + NH3 + NaCl + H2O =NaHCO3↓ + NH4Cl |
| B.向饱和NaCl溶液中先通入足量的CO2,再通入足量的NH3 |
| C.反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱 |
| D.CO2的结构式为O=C=O,其中碳氧原子均满足8电子稳定结构 |