物质的转化关系如下图所示,其中甲可由两种单质直接化合得到,乙为金属单质,F的溶液中只含有一种溶质,G为酸,乙在G的浓溶液中发生钝化。有的反应可能在水溶液中进行,有的反应中生成物未全部给出,反应条件也未注明。
(1)若用两根玻璃检分别蘸取A、G的浓溶液并使它接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。则
①1.7gA与O2反应生成气态的B和C时放出22.67J热量,写出该反应的热化学方程式 。
②D与乙反应的离子方程式是 。
③D的水溶液和F的水溶液中由水电离出的c(OH—) (填字母序号)。
(a)前者大 (b)后者大 (c)一样大 (d)不知浓度,无法比较
(2)若B为红棕色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①工业上反应I在 中进行,反应III在 (均填设备名称)中进行。
②由两种单质直接化合得到甲的反应条件是 或 。
③D和乙反应的离子方程式是 。
如图转化关系中A—H为中学常见化合物,甲、乙、丙、丁为常见单质,其中甲、丁常温为气体。已知单质乙、化合物A为黄色(或淡黄色)固体。乙经过连续与甲反应后,再与水化合,是工业上制H的反应过程。B、F两种气体都能使澄清石灰水变浑浊。(部分反应物或产物略去)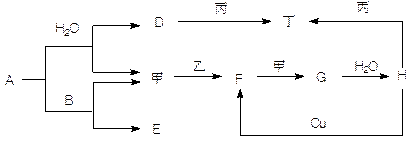
(1)写出下列物质的化学式:A________ F________ 甲_______ 丙________
(2)写出下列反应的化学方程式:A与B ______________________________
Cu与H ________________________________
(3)写出丙与D溶液反应的离子方程式 ________________________________
(4)常温时H的浓溶液与丙物质并不能看到明显的反应现象,原因是
。
已知有以下物质相互转化,其中A为单质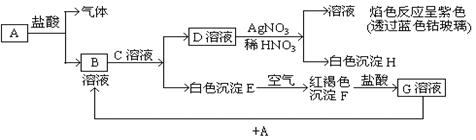
试回答:
(1)写出下列物质的化学式:
A ;B; H;F
;B; H;F
(2)写出由A转变成B的离子反应方程式
(3)写出用KSCN溶液鉴别G溶液的离子方程式
(4)写出G溶液加入A的有关离子反应方程式
已知B为黑色粉末,用D、E、G作焰色反应,隔蓝色钴玻璃观察,焰色均呈紫色,F为深红棕色液体,H能使淀粉变蓝,它们之间的相互转化关系如图所示。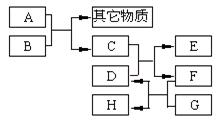
(1)请根据以上关系进行判断,指出下列物质的化学式:
A,C,D,G.
(2)写出下列反应的化学方程式:
C+D:;
A+B:。
在A和B的反应中,A显示出来的性质是(填写序号,多选倒扣)。
①只有还原性;②还原性和酸性;③只有氧化性;④氧化性和酸性
(3)C还能由以下反应制得:KClO3+6HCl=KCl+3Cl2↑+3H2 O,在该反应中,被氧化的氯元素与被还原的氯元素的物质的量之比为。
O,在该反应中,被氧化的氯元素与被还原的氯元素的物质的量之比为。
W、X、Y、Z均为短周期主族元素,W的最外层电子数与核外电子总数之比为3:8;X的核外电子总数与Y的最外层电子数相等,X的原子序数是Z的原子序数的一半;W、Y、Z位于同一周期。
(1)W的单质是一种 色晶体。
(2)W、Y、Z三种元素的气态氢化物稳定性由高到低的顺序是( 用化学式表示,Z的气态氢化物与其同主族元素气态氢化物化学式写法相似。)。
用化学式表示,Z的气态氢化物与其同主族元素气态氢化物化学式写法相似。)。
(3)已知A、B、C、D四种物质存在如下反应关系:A + B→C + D
①若A是Y和Z常见价态的化合物,B是X的氢化物,D是Y的氢化物,反应过程中没有化合价变化,该反应的化学方程式是。
②若A是Z的单质,B为红色固体,D为紫红色固体单质,高温下发生该反应,C的化学式是。D与X元素最高价氧化物对应水化物的浓溶液反应,生成的气体会对大气造成污染,其化学方程式是。用烧碱溶液吸收该气体生成两种盐,其中一种盐可用作防腐剂,烧碱溶液吸收气体的离子方程 式是。
式是。
四氧化三铅俗名“铅丹”或“红丹”,由于有氧化性被大量地用于油漆船舶和桥梁钢架防锈,其化学式可写为氧化物2PbO·PbO2或盐Pb2PbO4。欲测定某样品中四氧化三铅含量,进行如 下操作:
下操作:
①称取样品0.1000 g,加还原性酸溶解,得到含Pb2+的溶液。
②在加热条件下用过量K2Cr2O7将Pb2+沉淀为PbCrO4,冷却后过滤洗涤沉淀。
③将PbCrO4沉淀用酸溶液溶解(离子方程式为2PbCrO4+2H+=2Pb2++Cr2O72-+H2O),加入过量KI
溶液,再用Na2S2O3标准溶液滴定到终点(滴定过程中离子方程式为:I2+2S2O32-=2I-+S4 O62-)。
O62-)。
(1)已知Pb的原子序数是82,请写出Pb位于周期表的第_____周期____ __族。
__族。
(2)在PbCrO4浊液中加入少量酸,则Ksp(PbCrO4)(填“增大”、 “减小”、“不变”)
“减小”、“不变”)
(3)写出步骤③中加入过量KI后溶液中发生反应的离子反应方程式。
(4)欲求试样中Pb3O4的质量分数,还需要的数据有。
(5)Fe3O4与Pb3O4相似,其氧化物和盐的形式分别是、。