常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示,已知K甲(CaSO4)=9×10-6。下列说法正确的是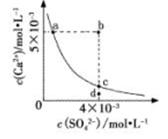
| A.a点对应的KSP小于c点对应的KSP |
| B.a点变为b点将有沉淀生成 |
| C.加入蒸馏水可以使c点变为d点 |
| D.含有大量SO2-4的溶液中肯定不存在Ca2+ |
下列说法正确的是
| A.焓变等于反应物的总能量减去生成物的总能量 |
| B.焓变等于反应物的键能总和减去生成物的键能总和 |
| C.断裂化学键是放热过程 |
| D.形成新的化学键是吸热过程 |
下列反应属于吸热反应的是
| A.C6H12O6(葡萄糖aq)+6O2 =6CO2+6H2O |
| B.CH3COOH+KOH = CH3COOK+H2O |
| C.A+B= C+D;△H<0 |
| D.反应物的总键能大于生成物的总键能 |
将9 g铜和铁的混合物投入100mL稀硝酸中,充分反应后得到标准状况下1.12L NO,剩余4.8 g金属;继续加入100mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是( )
| A.原混合物中铜和铁各0.075mo |
| B.稀硝酸的物质的量浓度为0.5mol·L-1 |
| C.第一次剩余4.8g金属为铜和铁 |
| D.再加入上述100mL稀硝酸,又得到标准状况下1.12L NO |
离子检验的常用方法有三种:
| 检验方法 |
沉淀法 |
显色法 |
气体法 |
| 含义 |
反应中有沉淀产生或溶解 |
反应中有颜色变化 |
反应中有气体产生 |
下列离子检验的方法不合理的是()
A.Ba2+------------气体法 B.Cl—-----------沉淀法
C.Fe3+-----------显色法 D.NH4+-----------气体法
在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如下图所示(b处NaOH的体积为1L),则下列判断不正确的是( )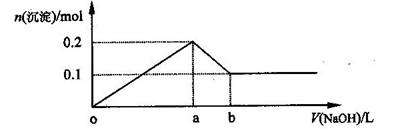
| A.NaOH的浓度为0.6 mol/L | B.在a点处溶液中的溶质为NaCl |
| C.在b点处溶液中的溶质只有NaAlO2 | D.图中线段oa : ab=5 : 1 |