下列用来表示物质变化的离子方程式中,正确的是
| A.明矾加入到氢氧化钡溶液中使硫酸根离子恰好沉淀 Al3+ + SO42- + Ba2+ + 4OH-= AlO2- + BaSO4↓+ 2H2O |
| B.铁加入到过量的稀硝酸溶液中:3Fe + 8H+ + 2NO3-= 3Fe2+ + 2NO↑ + 4H2O |
C.乙醛的银镜反应:CH3CHO+2 Ag(NH3)2+ +2OH- Ag(NH3)2+ +2OH-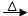 CH3COO-+NH4+ + 2Ag↓+3NH3↑+ H2O CH3COO-+NH4+ + 2Ag↓+3NH3↑+ H2O |
| D.向碳酸氢铵溶液中加入过量的氢氧化钠溶液:NH4+ + OH-= NH3·H2O |
0.1 mol某单质跟足量的硫充分反应后,质量增加1.6 g,则组成这种单质的元素是()
| A.铁 | B.铜 | C.铝 | D.钾 |
向50mL18mol/LH2SO4溶液中加入足量的铜片并加热。充分反应后,被还原的H2SO4的物质的量()
| A.小于0.45mol | B.等于0.45mol | C.在0.45mol和0.90mol之间 | D.大于0.90mol |
标准状况下H2S和O2混合气体100mL,经点燃后反应至完全,所得气体经干燥后,恢复到原来状况时体积为10mL,该10mL气体可能是()
| A.H2S、SO2 | B.O2 | C.H2S | D.SO3 |
右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是()

A.该试剂的物质的量浓度为9.2 mol·L-1 |
B.该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L |
C.配制200 mL 4.6 mol·L—1的稀硫酸需取该硫酸50 mL |
D.该硫酸与等体积的水混合所得溶液的质量分数小于49% |
取一定量铁粉和硫粉的混合物,隔绝空气加热使其充分反应,冷却后再加入足量的稀H2SO4,产生2.24 L气体(标准状况下)。则下列说法正确的是()
| A.2.24 L气体的质量一定小于或等于3.4 g | B.原混合物中一定含有5.6 gFe |
C.原混合物的质量不可能大于8.8 g | D.原混合物加热反应后的物质肯定是纯净物 |