化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
Ⅰ.有甲、乙两个容积相等的恒容密闭容器,
发生反应3A(g)+B(g)  xC(g) △H = QKJ/mol
xC(g) △H = QKJ/mol
回答下列问题:
(1)下列各项能作为判断该反应达到化学平衡状态的依据是 (填序号)
①化学反应速率:v(A)="3v(B) " ②混合气体的密度保持不变
③有3molA消耗的同时有1molB生成 ④ C的浓度保持不变
(2)根据试验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q 0(填“大于”或“小于”)
(3)向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC,将两容器的温度恒定在770K,使反应3A(g)+B(g)  xc(g)达到平衡,此时测得甲、乙两容器中C的体积分数均为0.2 。
xc(g)达到平衡,此时测得甲、乙两容器中C的体积分数均为0.2 。
①若平衡时,甲、乙两容器中A的物质的量相等,则x= ;
②平衡时甲中A的体积分数为 ;
③若平衡时两容器的压强不相等,则两容器中压强之比为
Ⅱ.(1)pH=3的盐酸a L,分别与下列3种溶液混合,充分反应后溶液呈中性:
①pH=11的氨水b L;②物质的量浓度为1×10-3 mol/L 氨水c L;
③c(OH-)=1×10-3 mol/L的Ba(OH)2溶液d L;
试判断a、b、c、d的大小关系正确的是
A.a=b>c>d B.b>a=d>c C.c>a>d>b D.c>a=d>b
(2)已知室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,两溶液中c(H+) • c(OH-)=___________;各取5mL上述溶液,分别加水稀释至50mL,pH较大的是________溶液;各取5mL上述溶液,分别加热到90℃,pH较小的是________溶液。
(3)同浓度的下列溶液:①NH4Al(SO4)2;②NH4Cl;③NH3·H2O;④CH3COONH4,其中c(NH4+) 由大到小的顺序是: (填编号)。
Ⅲ.一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm—),称为难溶电解质的溶度积。
(1)在25℃,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是 ;
(2)下列叙述不正确的是 (填字母)
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.25℃时,AgCl固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积相同。
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
在恒温时,向某密闭容器中通入2 mol X和1 mol Y气体,发生如下反应:2X(g)+Y(g) 2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4。
2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4。
(1)与上述平衡保持同温、同压,若向密闭容器中通入4 mol X(g)和2 mol Y(g),达到平衡,则Z的体积分数为_______;平衡时,气体X的体积分数为_______。
(2)与上述平衡保持同温、同压,若向密闭容器中通入X(g)和Y(g)的物质的量分别记为n(X)=m、n(Y)=n,并满足平衡时Z的体积分数为0.4,则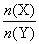 的取值范围为_______。
的取值范围为_______。
在一定条件下,将2 mol SO2和1 mol O2通入一个容积固定的密闭容器中,发生如下反应:2SO2+O2 2SO3,当此反应进行到一定程度时,反应混合物处于化学平衡状态。若维持容器温度不变,令a,b,c分别代表初始加入的SO2、O2和SO3的物质的量(mol)。如a,b,c取不同的值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的体积分数仍跟上述平衡时的完全相同。请填写下列空白:
2SO3,当此反应进行到一定程度时,反应混合物处于化学平衡状态。若维持容器温度不变,令a,b,c分别代表初始加入的SO2、O2和SO3的物质的量(mol)。如a,b,c取不同的值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的体积分数仍跟上述平衡时的完全相同。请填写下列空白:
(1)若a=0,b=0,则c=______;
(2)若a=0.5,则b=______,c=______;
(3)a,b,c必须满足的一般条件是(请用两个化学方程式表示,其中一个只含a和c,另一个只含b和c):__________________,________________________。
在密闭容器中进行的如下反应:2SO2(g)+O2(g)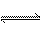 2SO3(g) ,SO2的起始浓度是0.4 mol·L-1,O2的起始浓度是1 mol·L-1。当SO2的转化率为80%时,反应达到平衡状态
2SO3(g) ,SO2的起始浓度是0.4 mol·L-1,O2的起始浓度是1 mol·L-1。当SO2的转化率为80%时,反应达到平衡状态
(1)求反应的平衡常数。
(2)若将平衡时反应混合物的压强增大1倍,平衡将如何移动?
(3)若平衡时反应混合物的压强减小1倍,平衡将如何移动?
(4)平衡时保持体积不变,向平衡混合气体中充入稀有气体Ar,使体系总压变为原来的3倍,平衡又将如何移动?
Ⅰ.恒温恒压下,在一体积可变的密闭容器中发生下列反应:4AC(g)+2BC2(g) 4AC2(g)+B2(g),在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是_______(用含a的代数式表示);
4AC2(g)+B2(g),在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是_______(用含a的代数式表示);
Ⅱ.若维持温度不变,在一个与Ⅰ反应前的起始体积相同容积固定的密闭容器中发生Ⅰ中所述的化学反应,开始时仍向容器中充入AC和BC2各1 mol,达平衡时生成AC2和B2共b mol,将b与Ⅰ中的a进行比较,则a_______b (填“>”“<”“=”或“不能确定”)
现有中学常见的三种单质甲、乙、丙,它们在一定条件下能发生如下变化,其中次要生成物已略去。
(1)已知乙元素的+2价离子与Ne原子具有相同的电子层结构,则②的离子方程式为____
____________________,④的化学方程式为________________________。
(2)若反应①可在常温下进行,则A的名称是_____________。若反应①需在加热条件下进行,则A的名称是_____________,反应的化学方程式为_____________________________。
(3)从C溶液中得到C需经过两步操作:先从C溶液中得到晶体,再将得到的晶体转化为C。从C溶液中得到晶体的过程被称为________________________,将得到的晶体转化为C的实验条件是______________________________________。