短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数,下列叙述正确的是
A. 原子半径 B. A的氢化物的稳定性大于C的氢化物
B. A的氢化物的稳定性大于C的氢化物
C. A的氧化物的熔点比C的氧化物高 D. A与C可形成离子化合物
标况下,将一盛有等体积NO、NO2的试管倒立在水槽中,充分反应后,下列叙述不正确的是(设试管中的溶质不往试管外扩散)()
| A.此反应中水既不是氧化剂又不是还原剂 |
B.试管内溶液中溶质的物质的量浓度为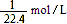 |
| C.溶液体积占试管容积的三分之二 |
| D.若将试管中的气体换为氯化氢或者氨气,则水充满试管 |
某溶液中含有SO32-、SiO32-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断正确的是()
①反应前后,溶液中离子浓度基本保持不变的是Na+ ②有胶状物质生成
③没有气体产生 ④溶液颜色发生变化 ⑤只发生了1个氧化还原反应
| A.①②④ | B.②③④ | C.①③⑤ | D.②④⑤ |
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应的特殊情况”。下列反应中属于这种情况的是( )
①过量的锌与18mol▪L-1的硫酸反应;
②过量的氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2反应;
④过量铜与18mol▪L-1的硫酸反应;
⑤过量硝酸与银反应;
⑥过量稀硫酸与块状石灰石反应。
| A.②③④⑥ | B.②③⑤ | C.①④⑤ | D.①②③④⑤⑥ |
将铜片放入盛有足量稀硫酸的烧杯中,若使铜片溶解,则不能在烧杯中加入()
| A.三氯化铁固体 | B.硝酸铵固体 | C.稀硝酸溶液 | D.硫酸亚铁固体 |
下列叙述不正确的是()
| A.H2S与SO2、NO与O2、NH3与HCl在常温下均不能大量共存 |
| B.(NH4)2SO3、Ca(ClO)2、NaAlO2均既能和稀硫酸又能和氢氧化钠溶液反应 |
| C.Fe(OH)3、FeCl2、FeCl3、NO均可通过化合反应得到 |
| D.AlCl3、Fe3O4、NaOH都可通过置换反应一步得到也可通过化合反应一步得到 |