已知1—18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
| A.质子数:c>b | B.离子的还原性:Y2->Z- |
| C.氢化物的稳定性:H2Y>HZ | D.原子半径X<W |
材料与化学密切相关,表中对应关系错误的是()
| 材料 |
主要化学成分 |
|
| A |
刚玉、金刚石 |
三氧化二铝 |
| B |
大理石、石灰石 |
碳酸钙 |
| C |
普通水泥、普通玻璃 |
硅酸盐 |
| D |
沙子、石英 |
二氧化硅 |
下列化合物中,不能由单质直接化合而得到的是()
①NH3 ②Na2O2③FeCl2 ④FeCl3 ⑤SO3 ⑥CuS ⑦FeS
| A.③⑤⑥⑦ | B.③⑤⑥ | C.④⑥⑦ | D.①③⑤⑦ |
ag铁粉与含有H2SO4的CuSO4溶液完全反应后,固体质量与反应前相同, 则
参加反应的CuSO4与H2SO4的物质的量之比为
| A.1 :7 | B.7 :1 | C.7 :8 | D.8 :7 |
下列物质中不能用化合反应的方法制的的是
① ②
②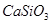 ③
③ ④
④ ⑤
⑤
| A.①③⑤ | B.②④ | C.② | D.④ |
向下列溶液滴加稀盐酸,生成白色沉淀,继续滴加稀盐酸,沉淀又溶解的是
| A.Na2SiO3 | B.BaCl2 | C.AgNO3 | D.NaAlO2 |