短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请回答:
(1)Y元素的名称是 。
(2)XZ3化合物的电子式是______________ 分子的立体构型
(3)分别写出X、Y的最高价含氧酸的分子式 、 。
12 g某有机物X完全燃烧后生成17.6 g CO2和7.2 g H2O。
(1)如果X是有刺激性气味的无色液体,与金属钠、碳酸钠均能反应并放出气体,则它的结构简式为____________________。
(2)如果X是易挥发有果香味的无色液体,并能水解,则它的结构简式为______。
(3)如果X的相对分子质量为90,跟醇、羧酸都能发生酯化反应,且两分子的X之间互相反应生成如下环酯: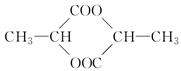 ,则X的结构简式为________________。
,则X的结构简式为________________。
化学式为C2H6O的化合物A具有如下性质:A+Na―→慢慢产生气泡
A+CH3COOH 有香味的产物
有香味的产物
(1)根据上述信息,对该化合物可作出的判断是
( )。
| A.一定含有—OH | B.一定含有—COOH |
| C.A为乙醇 | D.A为乙醛 |
(2)含A的体积分数为75%的水溶液可以用作______。
(3)A与钠反应的化学方程式:_____________。
(4)化合物A与CH3COOH反应生成的有香味的产物的结构简式为__________。
有机物M的结构简式如图所示。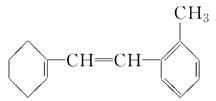
(1)有机物M的苯环上的一氯代物有________种。
(2)1 mol M与足量溴水混合,消耗Br2的物质的量为________mol。
(3)1 mol M与足量H2加成,消耗H2________ mol。
(4)下列有关M的说法中不正确的是________。
| A.在催化剂的作用下,M可与液溴发生取代反应 |
| B.M使溴水褪色的原理与乙烯使溴水褪色的原理相同 |
| C.M能使酸性KMnO4溶液褪色 |
| D.M和甲苯互为同系物 |
军用光敏材料KxFe(C2O4)y·3H2O(Fe为+3价)的实验室制备和测定其组成的方法如下所示:
Ⅰ.制备:
(1)用K2C2O4和FeCl3制备光敏材料的反应属于________(填序号)。
①离子反应 ②非氧化还原反应 ③氧化还原反应 ④化合反应
(2)结晶时应将饱和溶液放在黑暗处等待晶体的析出,这样操作的原因是_________。
(3)操作4的实验操作有____________。
Ⅱ.组成测定:
称取一定质量实验所得的晶体置于锥形瓶中,加足量蒸馏水和稀H2SO4,将C2O42-完全转化为H2C2O4,用0.10 mol·L-1 KMnO4溶液进行滴定,消耗KMnO4溶液24.00 mL时恰好完全反应(酸性条件下MnO4-的还原产物是Mn2+);再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00 mL。
(4)高锰酸钾氧化H2C2O4和Fe2+的离子方程式分别是___________; ________。
(5)配制100 mL 0.10 mol·L-1 KMnO4溶液及在上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外,还有________和________(写名称)。
(6)通过计算,该化合物的化学式是____________。
“氢能”被视为21世纪最具发展潜力的清洁能源。氢气的燃烧效率非常高,只要在汽油中加入4%的氢气,就可使内燃机节油40%。目前,氢能技术在美国、日本、欧盟等国家和地区已进入系统实施阶段。氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) ΔH=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________。
(2)H2S热分解制氢气时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是____________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均为非气体,写出该反应的化学方程式:________________。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图中A、B表示的物质依次是________。
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为________________。
(5)Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为____________。