已知25℃、101 kPa下,金刚石、石墨燃烧的热化学方程式分别为:
C(石墨,s)+O2(g)="==" CO2(g) △H=-393.51 kJ• mol-1
C(金刚石,s)+O2(g)="==" CO2(g)△H=-395.41 kJ• moL-1
据此判断,下列说法正确的是
| A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低 |
| B.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低 |
| C.由石墨制备金刚石是吸热反应;金刚石比石墨稳定 |
| D.由石墨制备金刚石是放热反应;石墨比金刚石稳定 |
分子式为C8H18的烷烃中,含有4个甲基的同分异构体的数目是
| A.5种 | B.6种 | C.7种 | D.8种 |
下列分子中的所有碳原子不可能在同一平面上的是
A.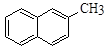 |
B. |
C.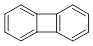 |
D.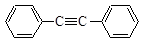 |
玻璃器皿上沾有一些用水洗不掉的残留物,其洗涤方法正确的是
①残留在试管内壁上的碘,用酒精洗涤
②盛放过苯酚的试剂瓶中残留的苯酚,用酒精洗涤
③做银镜反应后试管壁上的银镜,用稀氨水洗涤
④沾附在试管内壁上的油脂,用热碱液洗涤
| A.①③④ | B.②③④ | C.①②④ | D.①②③④ |
下列用系统命名法命名的有机物名称正确的是
| A.2-甲基-4-乙基戊烷 | B.3,4,4-三甲基己烷 |
| C.1,2,4-三甲基-1-丁醇 | D.2,3-二乙基-1-戊烯 |
能够鉴定溴乙烷中存在溴元素的实验操作是
| A.在溴乙烷中直接加入AgNO3溶液 |
| B.加蒸馏水,充分搅拌后,加入AgNO3溶液 |
| C.加入NaOH溶液,加热后加入稀硝酸酸化,然后加入AgNO3溶液 |
| D.加入NaOH的乙醇溶液,加热后加入AgNO3溶液 |