高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
| A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
| B.充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O |
| C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
短周期元素X、Y、 Z、W在元素周期表中的位置如下表,且Z族元素的化合物种类最多。则下列说法正确的是
| X |
Y |
||
| Z |
W |
A.Z单质的熔点是四种单质中最低的
B.Y的最高价氧化物的水化物酸性最强
C.碳元素可与W形成直线型分子
D.ZY4是由极性键形成的极性分子
X、Y、Z、W有如下图所示的转化关系,则X、W可能是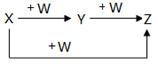
① AlCl3、NaOH② C、O2③ Cl2、Fe④ S、O2
A.①②③B.①②C.③④D.①②③④
下列离子方程式中正确的是
| A.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
| B.等体积、等物质的量浓度的NaHCO3溶液和Ca(OH)2溶液混合:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| C.向稀硫酸中加入铜粉:Cu + 2H+ = Cu2+ + H2↑ |
| D.向AlCl3溶液中加入过量氨水:Al3++3OH-=Al(OH)3 ↓ |
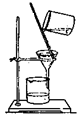
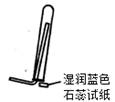
下列装置能达到实验目的的是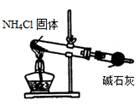
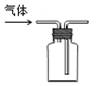
①②③④
| A.用①装置制取干燥的氨气 | B.用②装置除去淀粉溶液中的NaCl |
| C.③装置可用于氨气的收集、检验 | D.④装置可用排空气法收集氢气 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.1 mol Na2O2固体中含离子总数为4NA |
| B.标准状况下,22.4 L己烷中共价键数目为19NA |
| C.由乙烯和环己烷组成的混合物28g,含电子数为16NA |
| D.1 L浓度为1 mol·L-1的Na2CO3溶液中含有的CO32-数为NA |