根据下列热化学方程式
(1)C(s) + O2(g) = CO2(g) △H1=–393.5 kJ/mol
(2)H2(g) +  O2(g) = H2O(l) △H2=–285.8 kJ/mol
O2(g) = H2O(l) △H2=–285.8 kJ/mol
(3)CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l) △H3=–870.3kJ/mol
可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为:
| A.△H=+244.1kJ/mol | B.△H=-488.3kJ/mol |
| C.△H=-996.6kJ/mol | D.△H=+996.6kJ/mol |
某有机物的结构简式为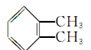 ,下列命名正确的是()
,下列命名正确的是()
| A.邻二甲苯 | B.1,6二甲苯 | C.1,2二甲苯 | D.乙苯 |
某烯烃与氢气加成后得到2,2-二甲基戊烷,烯烃的名称是()
| A.2,2-二甲基-3-戊烯 | B.2,2-二甲基-4-戊烯 |
| C.4,4-二甲基-2-戊烯 | D.2,2-二甲基-2-戊烯 |
根据有机化合物的命名原则,下列命名正确的是()
A.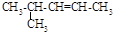 2-甲基-3-戊烯 2-甲基-3-戊烯 |
B.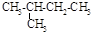 异丁烷 异丁烷 |
| C.CH3CH(C2H5)CH2CH2CH32-乙基戊烷 |
| D.CH3CH(NO2)CH2COOH 3-硝基丁酸 |
下列用系统命名法命名的有机物名称正确的是()
| A.2-甲基-4-乙基戊烷 | B.3,4,4-三甲基己烷 |
| C.1,2,4-三甲基-1-丁醇 | D.2,3-二乙基-1-戊烯 |
下列有机物的系统名称中,正确的是()
| A.2,4,4-三甲基戊烷 | B.4-甲基-2-戊烯 |
| C.3-甲基-5-异丙基庚烷 | D.1,2,4-三甲基丁烷 |