某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g) ΔH<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g) ΔH<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
| A.t2时加入了催化剂(其它条件不变) |
| B.t3时降低了温度(其它条件不变) |
| C.t5时增大了压强(缩小容器体积,其它条件不变) |
| D.平衡状态时,t6时刻Z的百分含量最低 |
国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如右图,下列关于该物质的说法正确的是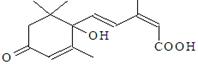
| A.其分子式为C15H21O4 |
| B.分子中只含有1个手性碳原子 |
| C.既能发生加聚反应,又能发生缩聚反应 |
| D.既能与FeCl3溶液发生显色反应,又能使酸性KMnO4溶液褪色 |
一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。已知:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160 kJ·mol-1
下列选项正确的是
| A.CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1 |
| B.CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH=+1734 kJ·mol-1 |
| C.CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l)ΔH=-x kJ·mol-1 x <574 |
| D.常温常压下用2.24 L CH4还原NO2至N2,整个过程中转移的电子为0.8 mol |
已知2SO2(g)+O2(g)  2SO3 (g)△H =-a kJ·mol-1(a>0)。恒温恒容下,在10L的密闭容器中加入0.1molSO2和0.05molO2,经过2min达到平衡状态,反应放热0. 025a kJ。下列判断正确的是
2SO3 (g)△H =-a kJ·mol-1(a>0)。恒温恒容下,在10L的密闭容器中加入0.1molSO2和0.05molO2,经过2min达到平衡状态,反应放热0. 025a kJ。下列判断正确的是
| A.在2min内,v (SO2)="0.25" mol·L-1·min-1 |
| B.若再充入0.1molSO3,达到平衡后SO3的质量分数会减小 |
| C.在1min时,c(SO2)+c(SO3)="0.01" mol·L-1 |
| D.若恒温恒压下,在10L的密闭容器中加入0.1molSO2和0.05molO2,平衡后反应放热小于0. 025a kJ |
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X形成的最高价氧化物对应的水化物的碱性强于Y。下列说法正确的是
| A.原子半径大小为Z>Y>X>W |
| B.W与X形成的化合物中可能含有共价键 |
| C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 |
| D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
用NA表示阿伏加德罗常数值,下列叙述正确的是
| A.1 molNa2O2与足量的水反应,转移的电子数为2NA |
| B.7.1 g Cl2完全参加反应,转移的电子数一定为0.1NA |
| C.电解饱和食盐水,生成1mol氢氧化钠,转移的电子数为2 NA |
| D.标准状况下,22.4L的CO2和O2组成的混合物中,含氧原子数为2NA |