常温下,某溶液中由水电离产生的c(H+)、c(OH-)满足c(H+)·c(OH-)=10-24,则下列各组离子在该溶液中可能大量共存的是
| A.NH4+、Fe2+、NO3-、SO42- | B.Ba2+ 、Na+、Cl-、NO3- |
| C.Na+、Cl-、SO42-、HCO3- | D.K+、Na+、AlO2-、Cl- |
氢氧燃料电池是将H2和O2通入电池,穿过浸入20%—40%的KOH溶液的多孔碳电极,其电极反应式分别为:2H2+4OH--4e-= 4H2O和O2+2H2O+4e-= 4OH-,下列不正确的是
| A.氢氧燃料电池属于环境友好电池 |
| B.通O2的极是正极,通入H2的极是负极 |
| C.工作一段时间后KOH溶液的溶质质量分数增大 |
| D.工作时溶液中的OH-向负极作定向移动 |
下列反应的离子方程式中,书写正确的是
| A.氯气溶于水:H2O + C12=2H+ +ClO-+Cl- |
| B.将铝粉投入氢氧化钠溶液中:2Al+2OH-=2AlO2-+H2↑ |
| C.铁粉与氯化铁溶液反应:Fe + Fe3+=2Fe2+ |
| D.过氧化钠与水反应:2Na2O2+ 2H2O = 4Na+ + 4OH+ O2↑ |
在一定条件下,反应N2+3H2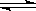 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
| A.V(NH3)=0.02mol/(L·min) | B.V(N2)=0.005mol/(L·min) |
| C.V(NH3)=0.17mol/(L·min) | D.V(H2)=0.03mol/(L·min) |
关于基本营养物质的说法正确的是
A.糖类、油脂、蛋白质都是都是高分子化合物
B.葡萄糖和蔗糖都能发生水解反应
C.糖类、油脂、蛋白质都是由C、H、O三种元素组成的
D.油脂在酸性条件下水解为丙三醇和高级脂肪酸
下列实验的现象与对应结论均正确的是
| 选项 |
操作 |
现象 |
结论 |
| A |
将浓硫酸滴到蔗糖表面 |
固体变黑 |
浓硫酸有吸水性 |
| B |
常温下将Al片放入浓硝酸中 |
无明显变化 |
Al与浓硝酸不反应 |
| C |
将NH3通过灼热的氧化铜固体 |
固体变红 |
氨气具有还原性 |
| D |
过量SO2通入含少量NaOH的酚酞溶液中 |
红色逐渐褪去 |
SO2具有漂白性 |