甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
① CH4(g)+H2O(g) 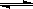 CO(g)+3H2(g) △H1
CO(g)+3H2(g) △H1
② CO(g)+2H2(g) 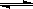 CH3OH(g) △H2
CH3OH(g) △H2
将0.20mol CH4和0.30 mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图。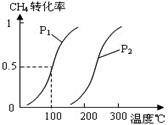
(1)已知在P1、100℃时达到平衡所需的时间为5min,则用CH4表示的平均反应速率为______。
(2)反应①的△H1 0,图中的P1______P2(填“<”、“=”或“>”)。
(3)在压强为0.1MPa条件下,将一定量CO与H2的混合气体在催化剂作用下能自发反应生成甲醇,则反应②的△H2 0,△S 0(填“<”、“=”或“>”)。
(4)根据题中给出的数据,计算反应①在100℃时的平衡常数值(写出计算过程及结果)
下列各组物质:
①O2和O3 ②H2、D2和T2 ③12C和14 C ④石墨和足球烯(C60)
(1)互为同素异形体的是_____________;(2)同一种物质的是_______________。
目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金。请回答:(题目中的百分含量均为质量分数)
(1)钢是含碳量为0.03%~2%的___________(填物质类别名称)。
(2)下图所示的装置中,甲、乙、丙三个烧杯分别盛放足量的溶液,电极及溶液如下表所示: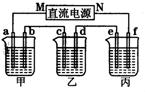
| 电极 |
a |
b |
c |
d |
e |
f |
| 石墨 |
石墨 |
铜 |
钢 |
钢 |
铜 |
|
| 溶液 |
NaCl溶液 |
CuSO4溶液 |
CuSO4溶液 |
通电后电极a上可产生能使湿润的碘化钾淀粉试纸变蓝的气体。
①上述装置中M极为直流电源的_________极(填“正”或“负”),电极b上发生的电极反应式为__________________________________________。
②若在钢币上镀铜,应选择_______烧杯(填“乙”或“丙”),当电极a上生成标准状况下气体2240 mL时,理论上可在电极_______(填字母)上镀铜_______g。
(3)工业上以铝土矿(主要成分Al2O3·nH2O,含少量的氧化铁和石英等杂质)为原料生产铝。为除去铝土矿样品中氧化铁和石英杂质,要将粉碎、筛选后的铝土矿样品溶解在足量的氢氧化钠溶液中处理,请写出有关反应的离子方程式__________________________。
(4)已知硬铝中含 Cu:2.2%~5%、Mg:0.2%~3%、Mn:0.3%~1.5%、Si:0.5%,其余是Al。1角硬币单枚质量为2.20克,若想制得1角硬币1百万枚,理论上至少需要含Al2O3 90%的铝土矿约_______吨(小数点后保留一位数字)。
Cu:2.2%~5%、Mg:0.2%~3%、Mn:0.3%~1.5%、Si:0.5%,其余是Al。1角硬币单枚质量为2.20克,若想制得1角硬币1百万枚,理论上至少需要含Al2O3 90%的铝土矿约_______吨(小数点后保留一位数字)。
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子各不相同,分别含有五种阳离子(Na+、Al3+、Mg2+、Ba2+、Fe3+)和五种阴离子(Cl-、OH-、NO3-、CO32-、X)中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是______________和______________(均填化学式)。
(2)为了确定X,现将 (1) 中的两种物质记为A、B,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生沉淀。向该沉淀中滴入过量稀HNO3,沉淀部分溶解,最后留有白色沉淀不再溶解。则:
①X为___________(填序号)。
A.SO32-B.SO42-C.CH3COO-D.SiO32-
②A中的化学键类型为______________。
③B的水溶液中所有离子的浓度由大到小的顺序为:_____________________________(用离子符号表示)。
④C与B混合时,对应的方程式为__________________________________ ___________。
___________。
(3)将Cu投入D溶液中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的______________(填相应的离子符号)。
(4)利用上述已经确定的物质,再做一个实验就可以确定D、E,该实验可以是_________。
A.向D、E中分别加入足量的NaOH B.向D、E中分别加入AgNO3溶液
C.观察溶液的颜色 D.分别测D、E溶液导电能力
铁及其化合物在日常生活中应用广泛,请回答下列问题:
(1)Fe(NO3)3·9H2O易溶于水,微溶于硝酸,主要用作催化剂和媒染剂,工业上用细铁屑与稀硝酸反应制备,主要流程如下: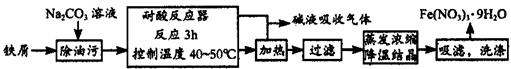
①Na2CO3溶液可以除油污,原因是(用离子方程式表示)_________________________;
②耐腐反应器中可以观察到如下的现象:铁屑__________,溶液颜色变为__________,有______色气体产生;制备过程中需控制加入铁屑的量,当观察到_______________的现象时应停止加入铁屑;
③制得的Fe(NO3)3·9H2O用20% HNO3洗涤,其原因是_________________________。
④若在实验中进行蒸发浓缩、降温结晶的操作,除带铁圈的铁架台、坩埚钳外,还需要的主要仪器有___________。
(2)某兴趣小组在实验室用细铁屑和稀硝酸制备Fe(NO3)3,装置如右图所示(固定所用仪器和加热装置未画出)。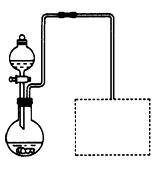
①该实验中对圆底烧瓶加热的最佳方式用_ _________加热;
_________加热;
②装置中圆底烧瓶上方长导管的作用是_________________;
③请在图中虚线框内画出防止倒吸的尾气吸收装置。(提示:碱液可快速、充分吸收产生的氮的氧化物气体)
A是生产某新型工程塑料的基础原料之一,其组成元素为C、H、O,其分子结构模型如图所示(图中球与球之间连线代表化学键,不一定表示单键)。

(1)根据分子结构模型写出A的结构简式______________________________。
(2)写出反应类型:反应①、⑤分别属于_______________、_______________。
(3)B与F均能与溴水中的溴发生加成反应,F的结构简式为______________________。
写出反应⑥的化学方程式(注明必要的反应条件)______________________________。
(4)已知G有多种芳香族同分异构体,其中符合下列条件的同分异构体共有___________种。
①能与稀硫酸及NaOH溶液反应
②能发生银镜反应
③分子中有一个甲基