具有漂白作用的物质有:①次氯酸 ②二氧化硫 ③活性炭 ④过氧化钠,其漂白原理相同的是
A ①③ B ②③ C ①④ D ②④
某反应2AB(g)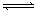 C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的△H、△S应为
C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的△H、△S应为
| A.△H<0,△S>0 | B.△H<0,△S<0 | C.△H>0,△S>0 | D.△H>0,△S<0 |
下列说法或表示方法正确的是
| A.等物质的量的硫蒸气和固体硫分别完全燃烧,后者放出热量多 |
| B.由C(石墨)= C(金刚石) △H=+1.90 kJ/mol可知,金刚石比石墨稳定 |
| C.在101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为: 2H2(g)+O2(g)=2H2O(l) △H=-285.8kJ/mol |
| D.在稀溶液中,H+(aq)+ OH-(aq)=H2O(l) △H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ |
下列与化学反应能量变化相关的叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.盖斯定律,可计算某些难以直接测量的反应的焓变 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同 |
下图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
为了测定此盐的钙元素含量,取10克此盐溶于水,加入足量盐酸,生成标准状况下67.2 ml二氧化碳气体。请计算此加钙食盐中钙元素的质量分数。
M2O7x- 和S 2- 离子在酸性溶液中发生如下反应:M2O7x- +3S2-+14H+ =2M3+ +3S↓+7H2O,
则M2O7x- 离子中M元素的化合价是()
| A.+2 | B.+3 | C.+4 | D.+6 |