A元素原子M电子层上有6个电子。B元素与A元素的原子核外电子层数相同,B元素的原子最外电子层只有1个电子。
(1)B元素的原子结构示意图为___________
(2)A、B两元素形成的化合物的名称是________
(3)用电子式表示B2A的形成过程
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2  N2O4;△H<0)
N2O4;△H<0)
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA___VB。(填“>”、“<”、“=”);若打开活塞K2,气球B将_____(填:变大、变小、不变)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将______(填增大或减小、不变);若通入等量的Ne气,则达到平衡时,A中NO2的转化率将_____,B中NO2的转化率将_______(填: 变大、变小、不变)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,_____中的颜色较深。
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为___
830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g) 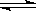 CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
试回答下列问题:
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
(2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是________。
(3)若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42-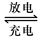 2PbSO4+2H2O
2PbSO4+2H2O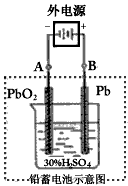
回答下列问题(不考虑氢、氧的氧化还原)
(1)放电时:正极的电极反应式是 ;电解液中H2SO4的浓度将变______,当外电路通过1mol电子时,理论上负极板的质量增加 g。
(2)在完全放电耗尽PbO2和Pb时,若按下图连接,电解一段时间后,则在A电极上生成__________,B电极上生成________,此时铅蓄电池的正负极的极性将____________。
下列物质之间有如下反应关系: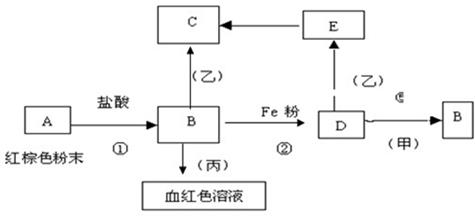
已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:
(1)写出下列物质的化学式:
A B D
甲 乙 丙
(2)写出E→C反应的化学方程式: 。
(10分)下列六个图中,横坐标为某溶液中加入某物质的物质的量,纵坐标为生成沉淀的物质的量,请把下表中各反应的相应图像的序号填入表中。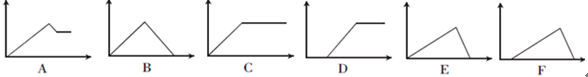
| 溶液 |
加入的物质 |
答案序号 |
| ①饱和石灰水 |
通过量CO2 |
|
| ②AlCl3溶液 |
通过量NH3 |
|
| ③MgCl2、AlCl3混合溶液 |
逐滴加NaOH溶液至过量 |
|
| ④AlCl3溶液 |
逐滴加NaOH溶液至过量 |
|
| ⑤含少量HCl的AlCl3溶液 |
逐滴加NaOH溶液至过量 |