元素性质呈现周期性变化的根本原因是
A.元素的相对原子质量递增,量变引起质变
B.元素原子的核外电子排布呈周期性变化
C .元素的原子半径呈周期性变化
.元素的原子半径呈周期性变化
D.元素的化合价呈周期性变化
科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为:
| A.H2+2OH-=2H2O+2e- | B.O2+4H++4e-=2H2O |
| C.H2 -2e-=2H+ | D.O2+2H2O+4e-=4OH- |
欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金属和电镀液均正确的是
| A.Ag和AgCl溶液 | B.Ag和AgNO3溶液 |
| C.Fe和AgNO3溶液 | D.Pt和Ag2SO4溶液 |
在Na2S溶液中c(Na+)与c(S2-)的比值是
| A.2 | B.小于2 | C.大于2 | D.1/2 |
将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是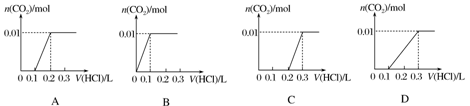
微粒检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1g样品加热,其质量变为w2g,则该样品的纯度(质量分数)是
A. |
B. |
C. |
D.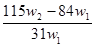 |