下列对某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO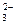 |
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不溶解,一定有CO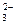 |
C.加入氢氧化钠并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH |
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白 色沉淀不溶解,一定有Ba2+ 色沉淀不溶解,一定有Ba2+ |
不能用平衡移动原理解释的事实是
| A.压缩盛有I2和H2混合气体的针筒,气体颜色变深 |
| B.pH均为4的盐酸和NH4Cl(aq)中水的电离度后者大 |
| C.打开汽水瓶盖,即有大量气泡逸出 |
| D.用排饱和食盐水的方法收集氯气 |
已知:S(s)+O2(g)→SO2(g)+297.23kJ………………①
2SO2(g)+O2(g)  2SO3(g) +196.64kJ……②
2SO3(g) +196.64kJ……②
假设反应过程中无热量损失,则
| A.1mol S(s)完全反应,并转化为SO3(g)时,放出395.55 kJ热量 |
| B.1个SO2和1个O2分子储存的能量之和大于1个SO3分子 |
| C.1 L SO2(g)完全反应生成1L SO3(g),放出98.32 kJ热量 |
| D.使用催化剂,可以减少反应②放出的热量 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.pH=1的溶液: Fe2+、Ca2+、I-、Br- |
| B.甲基橙呈黄色的溶液:Na+、K+、ClO-、AlO2- |
| C.0.1mol/L 的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| D.与铝反应产生大量氢气的溶液:Ba2+、Fe3+、C6H5O-、HCO3- |
化学反应中,有时“一种物质过量,另一种物质仍不能完全反应”。下列反应中不存在此类情况的是
| A.铁片与过量浓硝酸(常温) | B.铜粉与过量浓硝酸(常温) |
| C.浓盐酸与过量MnO2(共热) | D.浓硫酸与过量铜片(共热) |
甲烷与四氯化碳分子的空间构型相同,有关两者的比较中正确的是
| A.甲烷与四氯化碳分子都是含有极性键的极性分子 |
| B.甲烷与四氯化碳分子内的键角均为600 |
| C.甲烷沸点低于四氯化碳,因为C—H键键长比C—Cl键短 |
| D.甲烷分子比四氯化碳稳定,因为C—H键键能比C—Cl键大 |