某主族元素的原子最外层电子排布是5s1,下列描述中正确的是
| A.其单质常温下跟水反应不如钠剧烈 | B.其原子半径比钾原子半径小 |
| C.其碳酸盐易溶于水 | D.其氢氧化物不能使氢氧化铝溶解 |
a、b代表2种金属,下列叙述中,肯定能判断金属活动性a比b强的是()
| A.常温下,a能从水中置换出氢,而b不能 |
| B.原子的电子层数a比b多 |
| C.原子的最外层电子数a比b少 |
| D.1mola、b分别与足量盐酸反应,生成H2的质量a比b大 |
A、B、C为短周期元素,在周期表中如右图所示:A、C两种元素的原子核外电子数之和等于B原子的核电荷数。有关说法不正确的是()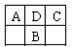
A.A的氧化物有多种形式
B.B的最高价氧化物对应的水化物是一种强酸
C.C的氢化物水溶液通常用玻璃试剂瓶盛放
D.D元素形成的单质不止一种
下表给出几种氯化物的熔沸点:对此有下列说法与表中数据一致的说法是()
| NaCl |
MgCl2 |
CaCl2 |
SiCl4 |
|
| 熔点(℃) |
801 |
782 |
712 |
-68 |
| 沸点(℃) |
1465 |
1600 |
1418 |
57 |
A.CaCl2晶体中的离子键比MgCl2晶体中的离子键强
B.801℃时,NaCl可形成气态
C.SiCl4是分子晶体
D.MgCl2水溶液不能导电
将NH4HCO3置于干的试管中加热,并使放出的气体依次通过盛有足量过氧化钠和碱石灰的干燥管,最后得到的气体有()
| A.NH3、O2 | B.H2O、O2 | C.CO2、O2 | D.O2 |
对于某些离子的检验及结论一定正确的是()
| A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |