A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Ag+ Na+ |
| 阴离子 |
NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、c三种溶液,电极均为石墨电极。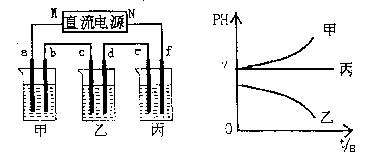
接通电源,经过一端时 间后,测得乙中C电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
间后,测得乙中C电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的 :极(填写“正”或“负”) ,甲、乙电解质分别为 、 (填写化学式)。
,甲、乙电解质分别为 、 (填写化学式)。
(2)写出d电极上发生反应的电极反应式 .
(3)若电解后甲溶液的体积为 25L,且产生的气体全部逸出则该溶液常温时的pH为 。
25L,且产生的气体全部逸出则该溶液常温时的pH为 。
(4)若丙装置产生的两种气体与氢氧化钠溶液、铂电极形成燃料电池,请写出正极的电极反应式: .
(5)要使电解后丙中溶液恢复到原来的状态,应加入 物质。(填写化学式)