下列化学用语使用正确的是 ( )
| A.Na2O2的电子式:Na:O::O:Na | |
| B.表示中和热的热化学方程式:NaOH+HC1=NaC1+H2O △H="—" 57.3kJ/mol | |
| C.苯酚钠溶液中通入CO2的离子方程式:C6H5O—+CO2+H2O=C6H5OH+HCO3— | | | |
D.CH3—CH—CH—CH—CH3的名称:2—甲基—3,4—二乙基戊烷 CH3 CH3C2H5 |
向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,可得到剩余的固体物质。已知:Na2SO3+I2+H2O===Na2SO4+2HI,则剩余固体物质的组成可能是
①NaCl、Na2SO4②NaCl、NaBr、Na2SO4③NaCl、Na2SO4、I2④NaCl、NaI、Na2SO4
| A.①② | B.②④ | C.①③ | D.③④ |
现有下列反应式,据两式判断,下列各组离子中,氧化性由强到弱的排列顺序正确的是
(1)2Fe3++2I—2Fe2++I2(2)Br2+2Fe2+2Fe3++2Br—
| A.Br2>Fe2+> I2 | B.Br2>Fe3+> I2 |
| C.I2> Br2>Fe3+ | D.Fe3+> Br2> I2 |
下列情况会导致所配氢氧化钠溶液浓度偏高的是
| A.仰视定容 |
| B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 |
| C.溶解氢氧化钠过程中,未冷却就转移 |
| D.容量瓶使用前有少量蒸馏水 |
用下图表示的一些物质或概念之间的从属或包含关系中,错误的是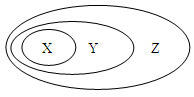
| X |
Y |
Z |
|
| 例 |
氧化物 |
化合物 |
纯净物 |
| A |
碘酒 |
分散系 |
混合物 |
| B |
液氨 |
电解质 |
化合物 |
| C |
胆矾 |
正盐 |
纯净物 |
| D |
NaHSO4 |
酸式盐 |
电解质 |
在同温同压下,A容器中的氧气(O2)和B容器中的氨气(NH3)所含的原子个数相同,则A、B两容器中气体的体积之比是
A.1:2 B.2:3 C.2:1 D.3:2