下列化合物中既有离子键又有共价键的是
| A.KBr | B.NaOH | C.HBr | D.N2 |
下列反应中,属于加成反应的是()
| A.乙烯使酸性KMnO4溶液褪色 | B.将苯滴入溴水中,振荡后水层接近无色 |
| C.乙烯使溴水褪色 | D.甲烷与氯气混合,光照一段时间后黄绿色消失 |
下图为短周期的一部分,推断关于Y、Z、M的说法正确的是()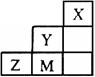
| A.非金属性:Y>Z>M | B.阴离子还原性Z2->M- |
| C.原子半径:M>Z>Y | D.Y的最高价氧化物的水化物的化学式为HYO4 |
下列化学式既能表示物质的组成,又能表示物质的一个分子的是()
| A.NaOH | B.SiO2 | C.Fe | D.C2H4 |
下列排序不正确的是 ()
| A.原子半径:C<Be<Mg<Na |
| B.稳定性:HI>HBr>HCl>HF |
| C.酸性:H4SiO4<H3PO4<H2SO4<HClO4 |
| D.碱性:KOH>Ca(OH)2>Mg(OH)2>Al(OH)3 |
现在含有元素硒(Se)的保健品市场火热,已知硒元素与氧元素同主族,与钾元素同周期,则下列关于硒的叙述中不正确的是()
| A.原子序数为24 | B.最高价氧化物的化学式为SeO3 |
| C.非金属性比S弱 | D.气态氢化物化学式为H2Se |