向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示。已知:2Fe2++Br2===2Fe3++2Br- 2Fe3++2I-===2Fe2++I2 ,则下列有关说法中,不正确的是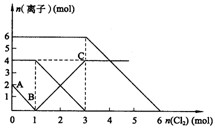
A.还原性: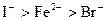 |
| B.原混合溶液中FeBr2的物质的量为6mol |
| C.当通入2molCl2时,溶液中已发生的离子反应可表示为: 2Fe2++2I-+2Cl2==2Fe3++I2+4Cl- |
| D.原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
下列实验过程中,始终无明显现象的是
| A.NO2通入FeSO4溶液中 | B.NH3通入AlCl3溶液中 |
| C.CO2通入CaCl2溶液中 | D.SO2 通入已酸化的Ba(NO3)2溶液中 通入已酸化的Ba(NO3)2溶液中 |
元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是
| A.元素原子的最外层电子数等于元素的最高化合价 |
B.多电子原子 中,在离核较近的区域内运动 中,在离核较近的区域内运动 的电子能量较高 的电子能量较高 |
| C.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强 |
| D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
| A.原子半径 A>B>D>C | B.原子序数d>c>b>a |
| C.离子半径 C>D>B>A | D.单质的还原性 A>B>D>C |
下图是一原电池的装置,关于它的说法正确的是
| A.装置中铜是负极 |
| B.铜表面的反应为:2H++2e-=H2↑ |
| C.电流的方向是从铁经导线流向铜 |
| D.构成原电池后,铁与硫酸铜的反应速率加快 |
下列离子方程式中正确的是
| A.碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3- + OH- = CO32-+ H2O |
| B.氯化铝溶液中加入过量氨水:Al3+ + 4NH3?H2O = AlO2-+ 4NH4+ +2H2O |
| C.二氧化氮通入水中:3NO2 + H2O = 2H+ + 2NO3— + NO |
| D.氯气通入水中的反应:Cl2+H2O= 2H++ Cl— + ClO— |