(8分)胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8•nH2O)等化合物。
(1)三硅酸镁的氧化物形式为 ,某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为 。
(2)铝元素的原子核外共有 种不同运动状态的电子、 种不同能级的电子。
(3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半 径  (填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:
(填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:
(4) Al2O3、MgO和SiO2都可以制耐火材料,其原因是 。
a.Al2O3、MgO和SiO2都不溶于水
b.Al2O3、MgO和SiO2都是白色固体 c.Al2O3、MgO和SiO2都是氧化物
c.Al2O3、MgO和SiO2都是氧化物
d.Al2O3、MgO和SiO2都有很高的熔点
(16分)FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:(16分)
(1)FeCl3净水的原理是 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中各离子浓度如下:则该溶液的pH约为 。
c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,
②NaClO3能在酸性条件下氧化FeCl2,写出离子方程式:
(3)FeCl3在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为: xFe3++yH2O Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是(填序号) 。
a.降温b.加水稀释 c.加入NH4Cld.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。
由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为 mg·L-1。
【有机化学基础 15分】化合物x是一种食品保鲜剂,它的结构简式为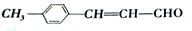 。
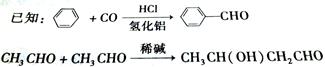
。
A是一种芳香烃,其蒸汽密度是氢气的46倍。气态物质C的密度在标准状况下为1.25g/L。合成X的路线如下: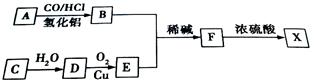
回答下列问题:
(1)A的名称是 ,F分子中含有的官能团名称是 。
(2)实验室制备C的化学反应方程式是 ,反应类型是 。
(3)写出B与E的反应方程式: 。
(4)Y是F的同分异构体,其苯环上只有一个取代基,既能发生水解反应也能发生银镜反应的同分异构体有 种。其中一种结构的核磁共振氢谱图有5组峰,峰面积之比为1︰1︰2︰2︰6,请写出其结构简式: 。
(5)根据下列合成路线回答问题:
试剂G的结构简式是 。
碳的氧化物在工业上有着广泛的应用,如CO 和H2可以合成甲醇,CO2和NH3可以合成尿素。(共计12分)
Ⅰ.若在20L的密闭容器中按物质的量之比1︰2充入CO和H2,发生反应:
CO(g)+ 2H2(g) CH3OH(g)。测得平衡时CO得转化率随温度变化及压强的变化如图所示:p2、195℃时,n(H2)随时间的变化如表所示:
CH3OH(g)。测得平衡时CO得转化率随温度变化及压强的变化如图所示:p2、195℃时,n(H2)随时间的变化如表所示:
| t/min |
0 |
1 |
3 |
5 |
| n(H2)/mol |
8 |
5 |
4 |
4 |
(1)p2、195℃时,0~1min内,υ(H2)= mol/(L·min)。
(2)你认为p1 p2; p2、195℃时,B点,υ(正) υ(逆)。(填“﹤”“﹥”或“=”)
(3)p2、195℃时,该反应的化学平衡常数为 ;
Ⅱ.NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如下:
(1)NH3(g)与CO2(g)反应生成尿素的热化学方程式为 。
(2)工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有 (填序号)
A.升高温度B.加入催化剂
C.将尿素及时分离出去D.增大反应体系的压强
运用有关原理,回答下列问题:(共计10分)
(1)25℃时,某FeCl3溶液的pH=2,则此溶液中由水电离产生的c(H+)= ,用离子方程式表示CH3COONa溶液呈碱性的原因: 。
(2)已知NaHSO4在水中的电离方程式为NaHSO4===H++ SO42-+Na+。在NaHSO4溶液中,c(H+) c(OH-)+ c(SO42-)(填“﹤”“﹥”或“=”,下同);室温下用NaHSO4溶液与Ba(OH)2溶液制取BaSO4,若溶液中的SO42-完全沉淀,则反应后溶液的pH 7。
(3)已知Ksp(BaSO4)=1.1×10-10。将等体积的Na2SO4溶液和BaCl2溶液混合,若Na2SO4溶液的浓度为0.02mol/L,则生成BaSO4沉淀所需的BaCl2溶液的最小浓度为 。
(忽略溶液混合时体积的变化)
Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
(1)B中反应的离子方程式是 .
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在________ .
(3)资料显示:SCN -的电子式为  .甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
.甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN﹣中被氧化的元素是 .
②甲同学通过实验证明了SCN﹣中氮元素转化为NO3﹣,已知SCN﹣中碳元素没有被氧化,若SCN﹣与Cl2反应生成1mol CO2,则转移电子的物质的量是 mol.
Ⅱ.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
(1)写出NaCN的电子式__________,偏碱性条件下,氰化钠溶液的CN﹣被双氧水氧化为HCO3﹣,同时放出NH3,该反应的离子方程式:_______ 。
(2)Cu2+可作为双氧水氧化CN﹣中的催化剂。某兴趣小组要探究Cu2+对双氧水氧化CN﹣是否起催化作用,请你完成下实验方案。填写实验步骤、实验现象和结论(己知:CN﹣浓度可用离子色谱仪测定)
| 步骤:分别取等体积、等浓度的含氰废水于甲、乙两支试管中,________________________________ ___________________________________________ ___________________________________________ __________________________________________ |
现象与结论: 若____________________________ _______________________________ 若____________________________ ____________________ |