下列实验设计及其对应的离子方程式均正确的是
| A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+="=" Cu2+ + 2Fe2+ |
| B.Na2O2与H2O反应制备O2:Na2O2 + H2O= 2Na+ + 2OH- + O2↑ |
| C.将氯气溶于水制备次氯酸:Cl2 + H2O= H+ + Cl- + HClO |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性: |
2MnO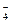 + 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2O
下列事实不能用电化学理论解释的是()
| A.镀层被划破后,镀锌的铁制品比镀锡的铁制品耐腐蚀 |
| B.轮船水线以下的船壳上镶嵌有一定量的锌块 |
| C.铝片不用特殊方法保存 |
| D.锌跟稀硫酸反应时,滴入少量硫酸铜溶液后反应速率加快 |
对A2+3B2 2AB3的反应,以下反应速率的表示中,速率最快的是()
2AB3的反应,以下反应速率的表示中,速率最快的是()
| A.v(AB3)=0.5mol/(L·min) |
| B.v(B2)=0.6mol/(L·min) |
| C.v(A2)=0.4mol/(L·min) |
| D.v(A2)=0.3mol/(L·min)" |
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是()
| A.元素X 的简单氢化物的沸点比W 的氢化物的沸点低 |
| B.元素Y 的最高价氧化物对应水化物的为强碱 |
| C.化合物YX、ZX2、WX2中化学键的类型相同 |
| D.原子半径的大小顺序: rY >rZ >rW >rX |
下列装置中能够形成原电池的是()
A、B、C均为短周期元素,它们在周期表中的位置如右下图。已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别是()
A.Be Na Al B.B Mg Si
C.O P Cl D.C Al P