已知某白色混合物粉末中含有CuSO4、K2SO4、NH4HCO3、NH4Cl、NaCl五种物质中的两种,且物质的量之比为1:1。请完成下述探究混合物组成的实验。
限选的仪器、用品和试剂:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙、酒精灯、火柴、试管夹、镊子;红色石蕊试纸、淀粉碘化钾试纸;1mol/L硫酸、1mol/L硝酸、1mol/L盐酸、1mol/L NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。
(一)初步探究
取适量固体混合物于烧杯中,加入蒸馏水搅拌,混合物完全溶解,得到无色透明溶液A,同时闻到有轻微的刺激性气味。用胶头滴管取少量溶液A于试管中,再滴加稀硝酸,溶液中有无色气泡产生;继续滴加过量稀硝酸至溶液中不再产生气泡,得到无色透明溶液B。
(1)上述实验可以得到的初步结论是
。
(二)进一步探究
(2)请设计实验方案进一步确定该固体混合物的组成。叙述实验操作、预期现象和结论。
| 实验操作 |
预期现象和结论 |
| |
|
| |
|
(12分)右图是某老师设计的一个微型实验装置图,请你说出实验过程中可能出现的现象,试写出有关化学方程式。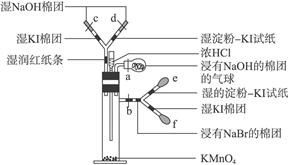
图中a、b、c、d均为止水夹,e、f为红皮头
已除去泥沙的粗盐中,仍含有Mg2+、Ca2+和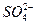 ,请填写下表中的空格,完成将粗盐提纯,得到氯化钠晶体的实验设计。
,请填写下表中的空格,完成将粗盐提纯,得到氯化钠晶体的实验设计。
| ① |
溶解 |
将粗盐放入烧杯中,加入适量的蒸馏水,充分搅拌,直至固体全部溶解 |
| ② |
沉淀 |
逐渐加入氢氧化钠溶液,直至不再出现沉淀为止 |
| ③ |
||
| ④ |
||
| ⑤ |
过滤 |
安装好过滤器,将④烧杯中的悬浊液沿玻璃棒加入过滤器中过滤 |
| ⑥ |
||
| ⑦ |
实验目的:粗盐提纯,得到纯净氯化钠晶体
实验用品:(1)药品:粗盐、NaOH溶液、HCl溶液、Na2CO3溶液、BaCl2溶液、pH试纸和蒸馏水。
(2)仪器:略
(不必叙述如何组装实验装置)实验问题讨论
(1)甲同学在多次过滤后,发现烧杯中的滤液仍浑浊,分析他的操作不当的原因可能是:
①_______________________________________________________________________。
②______________________________________________________________________。
(2)乙同学过滤后,滤液是澄清的,当取少量蒸发后的氯化钠晶体溶于水滴加硫酸钠溶液时,却出现白色沉淀。分析乙在实验步骤设计上存在的问题可能是____________________。
(16分)小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3·10H2O),为测定试样中小苏打的质量分数ω(NaHCO3),实验小组同学设计了如下装置进行实验。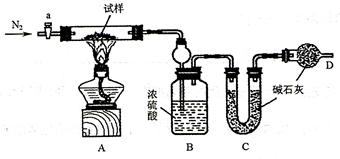
[实验过程]
①按图组装仪器,检查装置的气密性;
②将m1g试样放入硬质玻璃管中,装置B、C、D 中药品如图,己知加药品后装置B的质量为m2 g装置C 的质量为m3g;
③关闭活塞a,点燃酒精灯加热试样,直到B 装置中无气泡冒出后,打开活塞a 向装置中通人N2,一段时间后,撤掉酒精灯,关闭活塞a;
④称得装置B 的质量为m4g、装置C 的质量为m5g。
请回答以下问题(装置中原有空气对实验的影响忽略不计):
⑴装置A中发生反应的化学方程式为____________________________________
⑵装置B的作用为__________________________________________
装置C的作用为________________________________________________
⑶实验过程中通入N2的目的为__________________________________________
⑷用下列各项所提供的数据能计算出ω(NaHCO3)的是____________(填选项字母)。
| 序号 |
a |
b |
c |
d |
e |
| 数据 |
m1、m2、m3 |
m2、m3、 m4、m5 |
m1、m2、m4 |
m1、m4、m5 |
m1、m3、m5 |
⑸实验结束后发现装置A 中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的ω(NaHCO3),若能,则ω(NaHCO3)的计算式为:__________________;若不能,此问不作答。
有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,现做以下实验:
①将部分粉末加入水中,振荡有白色沉淀生成。
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生。
③取少量②的溶液,滴加稀硫酸,有白色沉淀生成。
④另取少量②的溶液,滴加AgNO3溶液,有白色沉淀生成。
请回答:
(1)根据上述实验现象,判断原白色粉末的组成成分是___________(填写名称)。
(2)写出①—④中涉及的化学方程式:
①______________________________
②_____________________________
③______________________________
④_____________________________
粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。为了除去杂质在实验室中可将粗盐溶于水然后进行下列操作:(1)过滤;(2)加入过量的氢氧化钠溶液;(3)加入适量的盐酸;(4)加过量Na2CO3溶液;(5)加过量的BaCl2溶液。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)以上操作的正确顺序是( )
| A.(5)(4)(2)(1)(3) | B.(1)(2)(3)(4)(5) |
| C.(5)(4)(3)(2)(1) | D.(1)(5)(4)(2)(3) |
(2)实验室进行NaCl溶液蒸发时,一般有以下操作过程:①放置酒精灯;②固定铁圈位置;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌;⑤停止加热。其正确的操作顺序为___________。
(3)如何运用最简的方法检验溶液中有无SO42―离子?______________________________。
如果有,应该如何除去SO42―离子?
___________________________________________。
(4)在粗盐经过溶解等步骤后,在过滤前的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止。这步操作的目的是
______________________________________________。
(5)将经过操作(4)后的溶液过滤。请问这一操作能除掉哪些杂质?
(6)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的。
溶解时:________________________________________。过滤时:________________________________________。蒸发时:________________________________________。