低合金高强度钢Q460是支撑“鸟巢”的铁骨钢筋,除含有铁元素外,还含有Mn(锰)、Ti(钛)、Cr(铬)、Nb(铌)等合金元素,下列有关说法正确的是
| A.Fe位于元素周期表的第四周期、第ⅧB族 |
| B.Q460比纯铁的硬度大 |
C.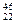 TiO2、 TiO2、 TiO2、 TiO2、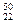 TiO2互为同位素 TiO2互为同位素 |
D.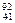 Nb3+原子核内有51个中子,核外有41个电子 Nb3+原子核内有51个中子,核外有41个电子 |
在相同状况下,一个空瓶,若装满O2称其质量为36 g,若装满CO2称其质量为42 g,若装满A气体,称其质量为52 g,则A的相对分子质量是( )
| A.16 | B.32 | C.64 | D.128 |
亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2===LiNH2+LiH,下列有关说法正确的是( )
| A.Li2NH中N的化合价是-1 |
| B.该反应中H2既是氧化剂又是还原剂 |
| C.Li+和H-的离子半径相等 |
| D.此法储氢和钢瓶储氢的原理相同 |
某未知溶液可能含Cl―、CO32―、Na+、SO42―、Al3+,将溶液滴在蓝色石蕊试纸上,试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断合理的是
| A.一定有Cl― | B.一定有SO42― | C.一定没有Al3+ | D.一定有CO32― |
下列有关Fe2(SO4)3溶液的叙述正确的是( )
| A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存 |
| B.和KI溶液反应的离子方程式: Fe3++2I-===Fe2++I2 |
C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO +Ba2++3OH-===Fe(OH)3↓+BaSO4↓ +Ba2++3OH-===Fe(OH)3↓+BaSO4↓ |
| D.1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe |
用FeCl3溶液腐蚀印刷电路板上的铜,所得溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是
| A.若无固体剩余,则溶液中一定有Fe3+ |
| B.若有固体存在,则溶液中一定有Fe2+ |
| C.若溶液中有Cu2+,则一定没有固体析出 |
| D.若溶液中有Fe2+,则一定有Cu析出 |