水的硬度表示方法是:将水中的Ca2+、Mg2+质量折算成CaO的质量。通常把1L水中含有10mg CaO称为1度,1L水中含有20mg CaO即为2度,以此类推。8度以上为硬水,8度以下为软水。我国规定饮用水的硬度不能超过25度。
(1)日常生活中,可用 检验某水样是硬水还是软水。
(2)Ca(HCO3)2加热时会分解产生一种白色沉淀(水垢的主要成分)和两种常见的氧化物,请写出发生反应的化学方程式 。河水、井水中溶有一定量的Ca(HCO3)2,饮用前可采取 的方法来降低水的硬度。
(3)家用热水瓶一旦产生水垢,其保温性能会降低。用稀盐酸可除去上述水垢,发生反应的化学方程式为 。
(4)取某水样1L,经实验测定,其中含Ca2+0.2g,此水样的硬度约为 ,是否符合饮用水标准? 。
某环保小组监测到一工厂向河水中排放的酸性废液中含有CuSO4。
(1)CuSO4是重金属盐,能与蛋白质发生_________变化(选填“物理”或“化学”),使蛋白质失去原来的生理功能,所以CuSO4有毒。
(2)为了测定废液中CuSO4的质量分数,该小组取了100g废液,逐滴加入NaOH溶液至过量.测得生成Cu(OH)2沉淀(无其它沉淀)的质量与所加NaOH溶液的质量关系如上图所示:
①说明图中的OA段未生成Cu(OH)2沉淀的原因。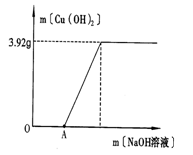
②计算废液中CuSO4的质量分数(写出计算过程,结果保留1位小数)。
③如果仍取l00g废液,向其中逐滴加入过量的BaCl2溶液,充分反应后,过滤,将所得沉淀洗涤、干燥称得质量为m g,能否用含m的代数式表达废液中CuSO4的质量分数?_____ (填“能’,或“不能”)并说明你的理由。
)维生素C(化学式为C6H8O6)对人体的健康有重要作用。经研究表明,青少年每天都需要摄入60mg的维生素C,若其中的12mg由水果补充。请计算回答:
维生素C中碳、氢、氧三种元素的质量比是,每个维生素C分子中含有个原子,维生素C中碳元素的质量分数为。(保留小数到0.1%)。
(1)人类生活离不开金属。铁是生活中常用的金属。如下图是某“取暖片”外包装的图片。
该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热 。
①发热剂需接触到空气才会发热,原因是铁要与、等物质共同作用才会生锈。
②推测发热剂成分中氯化钠的作用是。
(2)下表是几种清洁剂的功能、有效成分。
| 清洁剂名称 |
洁厕灵 |
活性彩漂 |
漂白精 |
| 功能 |
清除马桶内的污垢 |
漂洗衣物,使色彩更亮丽 |
快速漂除衣物污渍 |
| 有效成分 |
HCl |
H2O2 |
NaClO(次氯酸钠) |
据表回答下列问题:
①在盛有少量“活性彩漂”液体的试管中,加少量二氧化锰,其反应的化学方程式为,该反应属于反应。
②“洁厕灵”与“漂白精”不能混用。二者若混合会反应生成氯化钠、水和一种有毒气体,该反应的化学方程式为。
通过学习,我们可以从化学的角度看问题。豆浆机由于快捷方便而进入千家万户。请根据图示回答: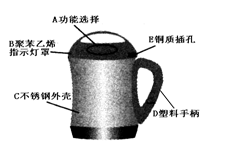
(1)制作材料中属于合金的是(填编号),制作手柄的塑料属于塑料(填“热塑性”或“热固性”)。(每空0.5分)
(2)豆浆已成为众多家庭的早餐饮品,以下是豆浆中一些营养成分的平均质量分数,根据下表回答:
| 成分 |
水 |
蛋白质 |
脂肪 |
糖类 |
钙 |
磷 |
铁 |
维生素A |
| 质量分数/% |
96.0 |
1.8 |
0.7 |
1.1 |
0.01 |
0.03 |
0.0005 |
0.015 |
①豆浆中含有的微量元素是。
②青少年缺乏元素易患有佝偻病,缺乏元素会引起贫血,缺乏维生素A,会引起。(每空0.5分)
③在豆浆所含的营养素中能供给人体能量的营养素有。
下图是甲乙两种固体物质的溶解度曲线。据图回答:
(1)P点的含义是_______。
(2)要使某温度时接近饱和的甲溶液变成饱和溶液,
可采用的方法有__________(写出一种)
(3)当甲中含有少量乙时,可采用____________的方法提纯甲 。
(4)30℃时,将40g甲物质放入盛有50g水的烧杯中,
所得溶液溶质的质量分数为____;若将烧杯内物质升
温到50℃(不考虑水蒸发),溶液中变化的是_____(选填A、B、C、D)
A、溶剂的质量 B、溶液的质量 C、溶质的质量分数 D、以上都不变