含有1mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是
| A.a是Fe(NO3)2 | B.n1 = 0.375 | C.p = 0.20 | D.n2 = 0.30 |
下列溶液中有关物质的量浓度关系错误的是
A.pH=2的HA与pH=12的MOH溶液任意比混合:c(H+) + c(M+) = c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) +c(OH-) = c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(A2-)>c(H2A)
在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)  M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
| 实验编号 |
温度/℃ |
起始时物质的量/mol |
平衡时物质的量/mol |
|
| n(X) |
n(Y) |
n(M) |
||
| ① |
700 |
0.40 |
0.10 |
0.090 |
| ② |
800 |
0.10 |
0.40 |
0.080 |
| ③ |
800 |
0.20 |
0.30 |
a |
| ④ |
900 |
0.10 |
0.15 |
b |
下列说法正确的是
A.实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为40%
D.实验④中,达到平衡时,b<0.060
将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是
| A.K1闭合,K2断开,铁棒上发生的反应为2H2O+O2+4e-=4OH- |
| B.K2闭合,K1断开,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体 |
| C.K2闭合,K1断开,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D.K1闭合,K2断开,石墨棒周围溶液pH逐渐升高 |
某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是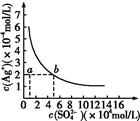
| A.含有大量SO42-的溶液中肯定不存在Ag+ |
| B.0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀 |
| C.Ag2SO4的溶度积常数(Ksp)为1×10-3 |
| D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
下列关于叙述正确的是
| A.室温下,浓度均为0.05mol/L的NaOH溶液和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12 |
| B.室温下,将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,2c(SO42-)>c(NH4+) |
| C.室温下,0.1mol/L的盐酸和0.1mol/L的氢氧化钡等体积混合,混合后溶液pH=7 |
| D.室温下,pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合后的溶液pH>7 |