某探究小组利用丙酮的溴代反应( )来研究应物浓度与反应速率的关系。反应速率v(Br2)通
)来研究应物浓度与反应速率的关系。反应速率v(Br2)通 过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
| 实验序号 |
初始浓度c/mol·l-1 |
溴颜色消失 所需时间t/s |
||
| CH3COCH3 |
HCl |
Br2 |
||
| ① |
0.80 |
0.20 |
0.0010 |
290 |
| ② |
1.60 |
0.20 |
0.0010 |
145 |
| ③ |
0.80 |
0.40 |
0.0010 |
145 |
| ④ |
0.80 |
0.20 |
0.0020 |
580 |
分析实验数据所得出的结论不正确的是
| A.增大c(CH3COCH3),v(Br2)增大 | B.实验②和③的v(Br2)相等 |
| C.增大c(HCl),v(Br2)增大 | D.增大c(Br2),v(Br2)增大 |
下列关于有机化合物的说法正确的是
| A.聚乙烯分子中含碳碳双键 | B.油脂的皂化反应属于加成反应 |
| C.丁烷有3种同分异构体 | D.以淀粉为原料可以制备乙醇 |
下列有关化学用语表达正确的是
A.HCl的电子式: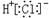 |
B.氯离子(Cl-)的结构示意图: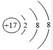 |
| C.乙酸的结构简式:C2H4O2 | D.质子数为17、中子数为20的氯原子: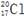 |
高铁酸钾是一种高效绿色水处理剂,其工业制备的反应原理为
2Fe(OH)3 + 3KClO + 4KOH = 2K2FeO4 + 3KCl + 5H2O,下列说法正确的是
| A.ClO−做还原剂 | B.制备1molK2FeO4时转移3 mol 电子 |
| C.高铁酸钾中铁的化合价为+7 | D.Fe(OH)3在反应中被还原,发生还原反应 |
下列比较不正确的是
| A.氢化物热稳定性:H2S>HCl | B.酸性:H2SO4>H3PO4 |
| C.碱性:NaOH>Mg(OH)2 | D.离子半径:O2->Na+ |
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是
| A.加入催化剂,减小了反应的热效应 |
| B.加入催化剂,可提高H2O2的平衡转化率 |
| C.反应物的总能量高于生成物的总能量 |
| D.H2O2分解的热化学方程式:H2O2 =H2O+1/2O2△H<0 |