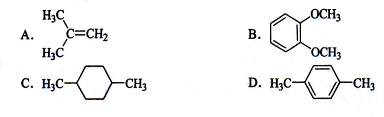坦克的制造材料主要是各种金属的合金,铁便是其中十分重要的一种。下列关于铁的说法中正确的是
| A.铁单质只具有还原性,其阳离子只具有氧化性 |
| B.常温下,单质铁与浓硫酸不反应 |
| C.铁元素属于过渡元素,其原子序数为26 |
| D.比较与相同浓度的盐酸反应生成氢气的速率,纯铁比生铁的快 |
香草醛广泛用于食品、饮料、烟草、酒类、医药、化工和各类化妆用品等,是一种性能稳定、香味纯正、留香持久的优良香料和食品添加剂。其结构如图所示,下列说法不正确的是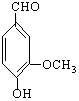
| A.香草醛的分子式为C8H8O3 | B.加FeCl3溶液,溶液不显紫色 |
| C.能与NaOH溶液反应 | D.能发生银镜反应 |
某学生做乙醛还原性的实验,取1mol/L的硫酸铜溶液2mL和0.4mol/L的氢氧化钠溶液4mL,在一个试管内混合后加入0.5mL40%乙醛溶液加热至沸,无红色沉淀。失败的原因是
| A.氢氧化钠的量不够 | B.硫酸铜的量不够 |
| C.乙醛溶液太少 | D.加热时间不够 |
分子式为C4H10O的醇催化氧化后能生成的醛有
| A.2种 | B.3种 | C.4种 | D.5种 |
为了鉴定溴乙烷中溴元素的存在,试分析下列各步实验,其中操作顺序合理的是
①加入AgNO3溶液②加入NaOH溶液③加热④用HNO3酸化溶液
| A.①②③④ | B.②③④① | C.④③②① | D.②③①④ |
在核磁共振氢谱中出现两组峰,其氢原子数之比为3∶2的化合物是