将0.01mol下列物质分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计);①Na2O2 ②Na2O ③Na2CO3 ④NaCl
| A.①>②>③>④ | B.①>②>④>③ |
| C.①=②>③>④ | D.①=②>③=④ |
运用有关概念判断下列叙述正确的是
| A.1molH2燃烧放出的热量为H2的燃烧热 |
| B.Na2SO3和H2O2的反应为氧化还原反应 |
C. 和 和 互为同系物 互为同系物 |
| D.BaSO4的水溶液不导电,故BaSO4是弱电解质 |
将Mg和Cu组成的混合物7.64 g投入足量的稀硝酸中使其完全反应,得到的唯一还原产物NO在标准状况下体积为2.24 L。将反应后的溶液稀释为1 L,测得溶液的pH=1,此时溶液中NO-3的浓度为
| A.0.3 mol/L | B.0.4 mol/L | C.0.5 mol/L | D.0.6 mol/L |
在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 mol铁粉,充分搅拌后铁完全反应,同时析出0.1 mol Ag。则下列结论中不正确的是
| A.向反应后的溶液中继续加入少量铁粉,铁粉可以继续溶解 |
| B.氧化性:Ag+>Fe3+>Cu2+>Zn2+ |
| C.反应后溶液的质量减轻 |
| D.反应后溶液中Cu2+与Fe2+的物质的量之比为1∶1 |
用右图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是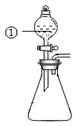
| 选项 |
①中物质 |
②中物质 |
预测②中的现象 |
| A. |
稀盐酸 |
碳酸钠与氢氧化钠的混合溶液 |
立即产生气泡 |
| B. |
浓硝酸 |
用砂纸打磨过的铝条 |
产生红棕色气体 |
| C. |
氯化铝溶液 |
浓氢氧化钠溶液 |
产生大量白色沉淀 |
| D. |
草酸溶液 |
高锰酸钾酸性溶液 |
溶液逐渐褪色 |
工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中
| A.硫元素在此过程中仅被还原 |
| B.氧化剂与还原剂的物质的量之比为1:2 |
| C.每生成1molNa2S2O3,转移4mo l电子 |
| D.相同条件下,每吸收10m3SO2就会放出2.5m3CO2 |