(5分)某种电池的电极材料为Al和Mg,电解质溶液为KOH,
(1) 电池的负极的电极反应式为__________
正极发生的是_______________反应(填反应类型);
(2) 总反应______________________________________________________________。
在MgCl2溶液中滴加少量NaOH溶液,现象为_________,继续加入过量的NaOH溶液,现象为_________;在AlCl3溶液中滴加少量NaOH溶液,现象为___________,继续加入过量的NaOH溶液,现象为______________。
维生素C又称"抗坏血酸",在人体内有重要的功能。例如,能帮助人体将食物中不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有________(填"氧化性"或"还原性)
酸、碱、盐在水溶液中发生的复分解反应,实质上是_______________。这类离子反应发生的条件是_______________________,只要具备上述条件之一,反应就能发生。
下表是某地区市场上销售的一种‘‘加碘食盐”的包装袋上的部分文字说明。
请根据此表,结合初中化学和生物学科的知识,回答下列问题。
| 配料表 |
精制海盐、碘酸钾 |
| 含碘量 |
20mg/kg~40 mg/kg |
| 储藏方法 |
密封、避光、防潮 |
| 食用方法 |
烹调时,待食品熟后加入碘盐 |
(1)碘是合成下列哪种激素的主要原料之一
A.胰岛素 B.甲状腺素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到食盐供应,易患。
A.甲状腺亢进 B.贫血症C.地方性甲状腺肿大 D.糖尿病
(3)食盐中加碘,这碘指的是 (填“元素”、“原子”或“单质”)。
(4)碘酸钾的化学式为KIO3,其中碘元素的化合价为 。
(5)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易 。
(6)有人认为仅用淀粉溶液即可检验出食盐中是否加碘。你认为他的观点 (填 “正确”、“不正确”)。
(1)补充完成F表:(请把序号①一⑦的答案对应填入答题卡上)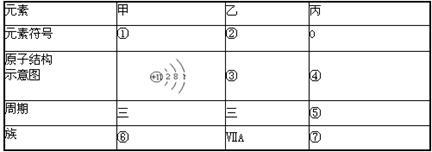
(2)甲元素最高价氧化物对应的水化物呈 性(填“酸、碱”),乙元素对应的最高价氧化物的水化物的化学式为 。
(3)甲与乙两元素的单质反应生成物的电子式为 。
(4)甲单质与丙的氢化物反应的化学方程式为 。