(7分)某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A H++HA- HA-
H++HA- HA- H++A2-
H++A2-
已知相同浓度时的电离程度α(H2A)> α(HA-),设有下列四种溶液:
(A)0.01mol.L-1的H2A溶液
(B)0.01mol.L-1的NaHA溶液
(C)0.01mol.L-1的HCl与0.04mol.L-1的NaHA溶液等体积混合液
(D)0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
(1) c(H+)最大的是
(2)在0.01mol.L-1的NaHA溶液中2C(A2- )+(C(HA-)+C C(OH-)-C(H+)=
(3) 0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合显 性原因
(用离子方程式表示)
在密闭容器里,通入x mol H2和y mol I2 (g),改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
(1) 升高温度;
(2) 加入催化剂;
(3) 充入更多的H2;
(4) 扩大容器的体积;
(5) 容器容积不变,通入氖气。
把除去氧化膜的镁条投入到盛有稀盐酸的试管中,产生氢气的速率变化情况如右图所示图中t1~t2速率变化的主要原因是__________,t2~t3速率变化的主要原因是。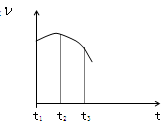
2SO2(g)+O2 (g)= 2SO3 (g),反应过程的能量变化如图所示。已知:1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ/mol。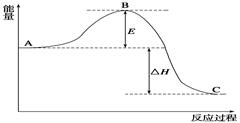
请回答下列问题:
(1)图中A、C分别表示、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是;
(2)图中ΔH= kJ/mol;
(3)如果反应速率v(SO2)为0.05 mol/(L·min),则v(O2)= mol/(L·min);
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH(要求计算过程)。
由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式:
。
已知H2O(l) = H2O (g) ΔH = +44 kJ·mol-1,则标准状况下33.6 L H2生成液态水时放出的热量是kJ。
有A、B、C、D四种元素,已知A元素原子的第一层和第三层电子数相同;B 元素原子的第二层比第一层电子数多5个;C元素的+3价阳离子和 氖原子具有相同的电子数;D元素的原子核外有4个电子层,第一层与第二层电子数之和等于第三层与第四层电子数之和。请写出:
(1)元素名称: A________,B________,C________,D________。
(2)A的原子结构示意图________,B的阴离子的化学式________,
C的离子结构示意图________,D的原子结构示意图________。