根据相关化学原理,下列判断正确的是 ( )
A、若X是原子晶体,Y是分子晶体,则熔点:X<Y
B、若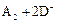 ═
═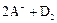 ,则氧化性:D2>A2
,则氧化性:D2>A2
C、若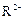 和
和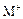 的电子层结构相同,则原子序数:R<M,离子半径:
的电子层结构相同,则原子序数:R<M,离子半径: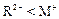
D、若弱酸HA、HB的酸性HA>HB,浓度相同的NaA和NaB溶液碱性NaA< NaB
下列分子或离子的空间构型为平面三角形的是
| A.SiH4 | B.H3O+ | C.SO32- | D.NO3- |
NH3分子空间构型是三角锥形,而CH4是正四面体形,这是因为
| A.NH3分子中N为sp2杂化,CH4分子中C为sp3杂化 |
| B.NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形成4个杂化轨道 |
| C.中心原子N、C都是sp3杂化,但NH3分子中N原子上的一未形成共价键的孤对电子对分子构型有影响,CH4分子中共价键完全相同且分子构型完全对称 |
| D.NH3分子中3个N—H键长大于CH4分子中4个C—H键长 |
下列说法与键能、键长无关的是
| A.H2O的沸点比H2S的高 | B.SiC的熔点比晶体硅的高 |
| C.O2比N2的化学性质更活泼 | D.HF比HCl稳定 |
下列分子或离子属等电子体的是
| A.CH4和NH3 | B.NO3-和CO32- | C.H3O+ 和PCl3 | D.CS2和SO2 |
下列有关σ键和π键的说法正确的是
| A.σ键是镜像对称,而π键是轴对称 |
| B.π键是由两个p电子“头碰头”重叠形成的 |
| C.σ键可沿键轴自由旋转而不影响键的强度 |
| D.π键比σ键重叠程度大,形成的共价键强 |