(1)已知:N2(g)+O2(g)=2NO(g);△H= +180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol
则N2(g)+3H2(g)=2NH3(g)的△H= 。
(2)工业合成氨的反应为N2(g)+3H2(g)  2NH3(g)。在一定温度下,将一定量的N2和H2通入固定体积为1L的密闭容器中达到平衡后,改变下列条件,能使平衡向正反应方向移动的是 。
2NH3(g)。在一定温度下,将一定量的N2和H2通入固定体积为1L的密闭容器中达到平衡后,改变下列条件,能使平衡向正反应方向移动的是 。
①增大压强 ②通入He
③使用催化剂 ④降低温度
(3)工业合成氨的反应为N2(g)+3H2(g)  2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为 。计算该条件下达到平衡时N2转化率为 ;
。计算该条件下达到平衡时N2转化率为 ;
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行右图所示实验:(其中c、d均为碳棒,NaCl溶液的体积为500ml)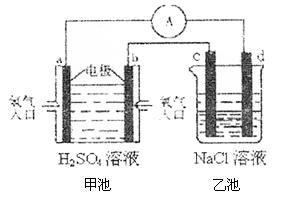
①b极为 极,电极反应式 ;
c极为 极,电极反应式 
②右图装置中,当b极上消耗的O2在标准状况下的体积为280ml时,则乙池溶液的PH为 (假设反应前后溶液体积不变,且NaCl溶液足量)
X、Y、Z、M、R、W均为周期表中前四周期的元素。X的基态原子外围电子排布式为3s2;Y原子的L电子层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子;M 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是海水中除氢、氧元素外含量最多的元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍。回答下列问题(相关回答均用元素符号表示):
(1)X的基态原子的外围电子排布式为,其基态原子有 种运动状态不同的电子;
(2)R的氢化物的稳定性比其上一周期同族元素氢化物的稳定性 (高或低)其原因是 ;
(3)ZM3﹣空间构型为 ,其中Z的杂化方式为 ;
(4)W与YM易形成配合物W(YM)5,在W(YM)5中W的化合价为 ;与YM分子互为等电子体的离子的化学式为 .
(5)W单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如下图A、B所示: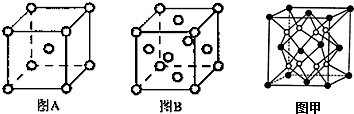
图B中原子堆积方式为 ,A、B中W原子的配位数之比为 .A、B晶胞的棱长分别为a cm和b cm,则A、B两种晶体的密度之比为 。
(6)X和W组成的合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图甲(黑球代表W,白球代表X).则该合金的化学式为 。
现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题。
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为:
2ZnS +3O2 2ZnO+2SO2;鼓风炉中:2C +O2
2ZnO+2SO2;鼓风炉中:2C +O2 2CO ZnO+CO
2CO ZnO+CO Zn + CO2
Zn + CO2
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
图1酸度对铟浸出率的影响图2液固比对铟浸出率的影响
①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______、_______。
(2)湿法炼锌的主要工艺流程为:
①从保护环境和充分利用原料角度,如何处理或利用烟气 。
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式 。
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式__________、__________。
硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1。
已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量甲并加热,写出反应的方程式: 。
(2)步骤2:始终保持C中溶液呈碱性,反应一段时间后,硫粉的量逐渐减少,打开K2、关闭K1并停止加热。
①C中溶液须保持呈碱性的原因:若呈酸性,则 、 。(用离子方程式表示)
②装置B、D的试剂相同,均为 。
步骤3:将C中所得混合物分离提纯后得产品。
(3)利用反应2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2也能制备Na2S2O3。所需仪器如图2,按气流方向连接各仪器,接口顺序为:a→____,____→ , → , →d。
(4)装置乙盛装的试剂是:_____________________________。
(5)Na2S2O3还原性较强,工业上常用作除去溶液中残留的Cl2,该反应的离子方程式为 。
(6)请设计简单的实验方案,证明上述残留的Cl2被还原成了Cl—:____________
海水是巨大的资源宝库。下图是人类从海水资源获取某些重要化工原料的流程示意图。
回答下列问题:
(1)操作B是_________________(填实验具体操作名称)。原因是________(用离子方程式表示)。
(2)操作A需加入下列试剂中的一种,最合适的是______(选填编号)。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液
(3)上图中虚线框内流程的主要作用是_________________;
(4)上图中虚线框内流程也可用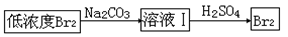 替代,请将Br2与Na2CO3反应的化学方程式补充完整并配平
替代,请将Br2与Na2CO3反应的化学方程式补充完整并配平
___Br2 + ___Na2CO3 = ___NaBrO3 + ___ + ___CO2
(5)写出将MgCl2转化为Mg时获得的副产品的一种用途(用方程式表示)____________。
300℃下,将2 mol SO2 1 mol O2混合于2 L的恒容密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g)ΔH,2分钟末达到平衡,测得SO2的转化率为60%。请根据化学反应的有关原理回答下列问题:
2SO3(g)ΔH,2分钟末达到平衡,测得SO2的转化率为60%。请根据化学反应的有关原理回答下列问题:
(1)能证明反应已经达到平衡状态的是
①c(SO2):c(O2):c(SO3)=2:1:2
②单位时间内生成nmol SO3的同时消耗nmol SO2
③反应速率2v(SO3)= v(O2)
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
(2)如图表示该反应的速率(v)随时间(t)的变化的关系:
据图分析:你认为t3时改变的外界条件可能是________;t6时保持体积不变向体系中充入少量He气,平衡 移动。(填“向左”“向右”或“不”)。SO2%含量最高的区间是
(t0~t1,t2~t3,t3~t4,t5~t6)。
(3)300℃时,该反应的平衡常数为 ,若升高温度该反应的平衡常数减小,则ΔH 0(填“大于”小于“或“不确定”)
(4)如果在相同条件下,上述反应从逆反应方向进行,开始时加入SO20.6 mol加入SO31.4 mol,若使平衡时各物质的量浓度与原来平衡相同,则还应加入O2 mol。