选择萃取剂将碘水中的碘萃取出来,这中萃取剂应具备的性质是B
| A.不溶于水,且必须易与碘发生化学反应 |
| B.不溶于水,且比水更容易使碘溶解 |
| C.不溶于水,且必须比水密度大 |
| D.不溶于水,且必须比水密度小 |
根据下图把煤隔绝空气加强热,下列叙述错误的是( )
| A.图中发生了化学变化 |
| B.X水溶液的pH>7;Y是一种黑色黏稠液体 |
| C.气体Z易燃,可还原CuO,也可使溴水褪色 |
| D.试管A中产生浓的白色烟 |
目前人们正在研究开发一种高能电池——钠硫电池,它是以熔融的钠、硫为两极,以Na+导电的β′Al2O3陶瓷作固体电解质,反应如下:
2Na+xS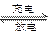 Na2Sx
Na2Sx
以下说法,正确的是( )
| A.放电时,钠作正极、硫作负极 |
| B.放电时,钠极发生还原反应 |
| C.充电时,钠极与外接电源正极相连,硫极与外接电源负极相连 |
D.充电时,阳极发生的反应是: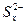  xS+2e- xS+2e- |
铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4,工作时的反应为Pb+PbO2+2H2SO4====2PbSO4+2H2O,下列结论正确的是( )
| A.Pb为正极被氧化 |
| B.溶液的pH不断减小 |
C.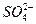 只向PbO2处移动 只向PbO2处移动 |
| D.电解质溶液pH不断增大 |
已知天然气的主要成分CH4是一种会产生温室效应的气体,等物质的量的CH4和CO2产生的温室效应,前者大。下面是有关天然气的几种叙述,其中正确的是( )
①天然气与煤、柴油相比是较清洁的能源 ②等质量的CH4和CO2产生的温室效应也是前者大 ③燃烧天然气也是酸雨的成因之一
| A.是①②③ |
| B.只有① |
| C.是①和② |
| D.只有③ |
某人坐在空调车内跟在一辆卡车后面,观察到这辆卡车在起动、刹车时排出黑烟,由此可推断这辆卡车所用的燃料是( )
| A.酒精 |
| B.汽油 |
| C.柴油 |
| D.液化石油气 |