已知两种弱酸的酸性:HA>HB,在常温下下列各项比较中正确的是 ( )
A.两种溶液① 0.1mol/L HA溶液;②0.3mol/L HA溶液与0.1mol/L NaOH溶液等体积的混合液,c(H+):①<②
B.等物质的量浓度的HA溶液与NaB溶液等体积的混合液:
2c(Na+)=c(A-)+c(B-)+c(HA)+c(HB)
C.pH=9的三种溶液①NaB;②NH3·H2O;③NaOH,由水电离出的c(OH-):①>②>③
D.物质的量浓度相等的NaA与KB两溶液中:>
下列各组有机物,它们以任意物质的量之比混合,只要混合物的物质的量一定,在完全燃烧时,消耗的氧气的量恒定不变的是()
| A.C3H6和C3H8 |
| B.C4H6和C3H8 |
| C.C6H10和C6H6 |
| D.C3H8和C4H4 |
0.5 mol某气态烃,恰好与1 mol HCl加成,生成物分子中的氢又可被3 mol Cl2恰好取代,则此气态烃可能是()
| A.C2H2 | B.C2H4 | C.CH≡C—CH3 | D.CH2==C(CH3)2 |
下列8种物质:①苯 ②甲烷 ③聚乙烯 ④苯乙烯
⑤2-丁炔 ⑥己烷 ⑦邻二甲苯 ⑧戊烯,其中既能使高锰酸钾酸性溶液褪色,又能与溴水反应使之褪色的是()
| A.③④⑤ | B.④⑦⑧ | C.④⑤⑧ | D.③④⑧ |
有一种有机物,因其酷似奥林匹克五环旗,科学家称其为奥林匹克烃
(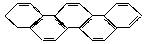 )。下列有关奥林匹克烃的说法正确的是( )
)。下列有关奥林匹克烃的说法正确的是( )
| A.该烃分子中只含极性键 |
| B.该烃是只含非极性键的非极性分子 |
| C.该烃完全燃烧生成H2O的物质的量小于CO2的物质的量 |
| D.该烃分子式符合通式CnH2n-6 |
在一定条件下,将A、B、C三种炔烃所组成的混合气体4 g,在催化剂作用下与足量的H2发生加成反应可生成4.4 g对应的三种烷烃,则所得烷烃中一定有()
A.戊烷 B.丁烷 C.丙烷 D.乙烷