某烃A 0.2 mol在氧气中充分燃烧后,生成化合物B、C各1 mol。
⑴烃A的分子式为 。
⑵若烃A不能使溴水褪色,但在一定条件下, 能与Cl2发生取代反应,其一氯代物只有一种,则A的结构简式为 。
能与Cl2发生取代反应,其一氯代物只有一种,则A的结构简式为 。
⑶若烃A能使溴水褪色,在催化剂作用下与H2加成,其加成产物分子中含有3个甲基,则A可能的结构简式为 ;
;
其中有一种分子,所有碳原子都在同一平面内,它发生加聚反应的化学方程式为 。
现有下列十种物质:①液态HCl ②NaHCO3③NaCl溶液 ④CO2⑤蔗糖晶体 ⑥Ba(OH)2⑦红褐色的氢氧化铁胶体 ⑧NH3·H2O ⑨空气 ⑩Al2(SO4)3
(1)上述十种物质中有两种物质在水溶液中可发生反应,离子方程式为:H++OH-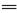 H2O,该反应的化学方程式为。
H2O,该反应的化学方程式为。
(2)⑩在水中的电离方程式为,
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式:;如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,此时最好用含Al(OH)3的胃药(如胃舒平),它与胃酸反应的离子方程式:
(4)向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
①写出反应的离子方程式。
水在很多的反应中,起到极其重要的作用。根据下面水参与的反应,回答问题:
①2F2+2H2O==4HF+O2
②2Na2O2+2H2O="=" 4NaOH + O2↑
③2Na+2H2O==2NaOH+H2↑
④2H2O 2H2↑+O2↑
2H2↑+O2↑
(1)水只作氧化剂的是;(填写序号,下同)水只作还原剂的是;水既作氧化剂,又做还原剂的是;水既不是氧化剂,又不是还原剂的氧化还原反应是。
(2)请标出下列反应的电子转移的方向和数目。3Cl2 +6 NaOH=5NaCl + NaClO3 + 3H2O
(3)上述反应3Cl2+ 6NaOH=5NaCl + NaClO3 + 3H2O若转移5mol电子,则所得氧化产物的物质的量为mol。
(1)若NA为阿伏伽德罗常数,则3.4g氨气中所含氢原子个数为。
(2)约3.01×1023个OH-的质量为 g,含有电子的物质的量为,这些OH-与mol NH3的质量相同。
(3)将4gNaOH固体溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为 __mol/L。取出10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为_____________mol/L。
(4)现有M、N两种气态化合物,其摩尔质量之比为2:1,试回答下列问题:
①同温同压下,M、N气体的密度之比为____________
②相同温度下,在两个相同体积的密闭容器中分别充入M、N,若两个容器中气体的密度相等,则两个容器中的压强之比为____________
③将M、N两种气体分别溶于水(M、N与水均不反应)配成溶液,当两种溶液的质量分数相同时,其密度分别为d1和d2,则两种溶液的物质的量浓度之比为____________。
(1)在实验室制取蒸馏水时,烧瓶中应放几粒沸石(或碎瓷片),其作用是________;
(2)温度计的水银球应位于,
(3)水冷凝管中冷凝水的流向应当与水蒸气的流向。
已知二氧化硫可使酸性高锰酸钾溶液褪色,化学反应方程式为:





 5SO2 + 2KMnO4 + 2H2O ="==" K2SO4 + 2MnSO4 + 2H2SO4用下图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2
5SO2 + 2KMnO4 + 2H2O ="==" K2SO4 + 2MnSO4 + 2H2SO4用下图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2
(1)实验时,反应产生的气体应从端通入;从端连接盛有澄清石灰水的实验装置(用“a”或“b”填空)。
(2)A瓶的实验现象是。
(3)C瓶溶液的作用是 。