在容积固定的密闭容器中存在如下反应:A(g)+3B(g) 2C(g)(正反应为放热反应)。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g)(正反应为放热反应)。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图: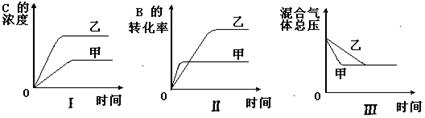
下列判断一定错误的是()
| A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高 |
| B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高 |
| C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高 |
| D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |
已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g)△H <0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如图。下列说法不正确的是()
N2O4(g)△H <0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如图。下列说法不正确的是()
| A.图中的两条曲线,X表示NO2浓度随时间的变化曲线 |
| B.前10 min内用v(N2O4 ) =" 0.2" mol/(L·min) |
| C.25 min时,NO2转变为N2O4的反应速率增大,其原因是将密闭容器的体积缩小为1L |
| D.前10 min内用v(NO2) =" 0.04" mol/(L·min) |
下列热化学方程式正确的是(注: 的绝对值均正确)( )
的绝对值均正确)( )
| A.C2H5OH(l)+3O2(g)=2CO2(g) +3H2O(g);△H=" —1367.0" kJ/mol(燃烧热) |
| B.NaOH(aq) + HCl(aq)="NaCl(aq)" + H2O(l);△H= —57.3kJ/mol(中和热) |
| C.S(s) + O2(g) = SO2(g);△H= —269.8kJ/mol(反应热) |
| D.2HCl(g)=Cl2(g) + H2(g);△H=" —" 184.6kJ/mol(反应热) |
难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
TaS2 (s)+2I2 (g)  TaI4 (g)+S2 (g)
TaI4 (g)+S2 (g)
下列说法正确的是()
| A.在不同温度区域,TaI4 的量保持不变 |
| B.在提纯过程中,I2 的量不断减少 |
| C.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区 |
| D.该反应的平衡常数与TaI4 和S2 的浓度乘积成反比 |
下列说法中正确的是()
| A.凡是放热反应都是自发的,由于吸热反应都是非自发的 |
| B.自发反应在恰当条件下才能实现 |
| C.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
| D.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 |