氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
| A.一个D2O分子所含的中子数为8 | B.NH3的结构式为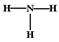 |
C.HCl的电子式为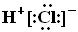 |
D.热稳定性:H2S>HF |
常温时,下列关于电解质溶液的叙述正确的是
| A.稀释pH= 10的氨水,溶液中所有离子的浓度均降低 |
| B.常温下物质的量浓度相等的①(NH4)2CO3、②NH4Al(SO4)2、③(NH4)2Fe(SO4)2三种溶液中c (NH4+):③>①>② |
| C.pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH前者一定大于后者 |
D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的 量多 量多 |
在容积不变的密闭容器中有反应:X(g) + Y(g) 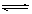 z(g),若Z(g)的物质的量浓度c(Z)
z(g),若Z(g)的物质的量浓度c(Z) 与温度T的关系如右图所示。
与温度T的关系如右图所示。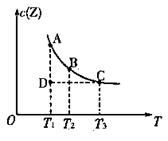
则下列说法不正确的是
A.A点与B点相比,B点的c (X)大
B.A点与C点的化学反应速率:前者<后者
C.在反应进行到D点时,V正<V逆
D.A、B、C点都表示该反应达平衡状态
下列叙述正确的是
A.恒容密闭容器中进行的反应3A(g)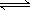 B(g)+C(g),在其它条件不变情况下, B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将增大 |
| B.对于可逆反应N2(g)+3H2(g)==2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增加 |
| C.将AlCl3溶液和NaAl02溶液分别蒸干后灼烧,所得固体产物均为Al2O3 |
| D.反应NH3(g)+HCl(g)=NH4Cl(s) △H<0在任何条件下均能自发进行 |
某烷烃的各种同分异构体中,主链上有4个碳原子的只有两种结构,则含有相同碳原子数且主链上也有4个碳原子的烯烃(只含一个碳碳双键)的同分异构体有
| A.2种 | B.3种 | C.4种 | D.5种 |
下列说法不正确的是
| A.木糖醇(C5H12O5)是一种甜味剂,它属于多羟基化合物,与葡萄糖互为同系物 |
| B.用核磁共振氢谱可以鉴别l一溴丙烷和2一溴丙烷 |
| C.外加直流电源,将钢铁设备作为阴极进行保护 |
| D.锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去 |