已知自然界氧原子有3种16O、17O、18O,氢原子有2种H、D,从水分子的组成来看,自然界的水一共有
| A.3种 | B.6种 | C.9种 | D.12种 |
苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等作用的保健食品。苹果酸(α羟基丁二酸)是这种饮料的主要酸性物质,其结构如下图所示:
下列相关说法正确的是()
| A.苹果酸在一定条件下能发生消去反应 |
| B.苹果酸在一定条件下能催化氧化生成醛 |
| C.苹果酸在一定条件下能发生加聚反应生成高分子化合物 |
| D.1 mol苹果酸与NaHCO3溶液反应最多消耗3 mol NaHCO3 |
有机物乙苯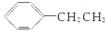 的一溴取代物的同分异构体有()
的一溴取代物的同分异构体有()
| A.5种 | B.6种 | C.7种 | D.8种 |
分子式为C5H10O2的酯共有(不考虑立体异构)()
| A.7种 | B.8种 | C.9种 | D.10种 |
分子式为C5H11Cl,在NaOH溶液中加热反应,生成的有机物在Cu的催化作用下加热反应,氧化产物能发生银镜反应的有(不考虑立体异构)()
| A.2种 | B.4种 | C.6种 | D.8种 |
分子式为C4H8Cl2的有机物,分子中含2个甲基的同分异构体有(不含立体异构)()
| A.3种 | B.4种 | C.5种 | D.6种 |