对下列化学用语的理解和描述均正确的是
A.电子式 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
B.原子结构示意图 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
C.球棍模型 可以表示二硫化碳分子,也可以表示水分子 可以表示二硫化碳分子,也可以表示水分子 |
D.结构示意图为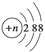 的阴离子都能破坏水的电离平衡 的阴离子都能破坏水的电离平衡 |
常温下,有下列4种溶液,下列说法正确的是
| ① |
② |
③ |
④ |
| 0.1 mol·L-1 CH3COOH溶液 |
pH=3 CH3COOH溶液 |
0.1 mol ·L-1 NaOH溶液 |
pH=11 NaOH溶液 |
A.由水电离出的c(H+):③>①
B.①稀释到原来的100倍后,pH与②相同
C.①与③混合,若溶液pH=7,则两种溶液的体积:③>①
D.②与④混合,若溶液pH=7,则两种溶液的体积:④>②
已知常温时CH3COOH的电离平衡常数为K。该温度下向20mL0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。
下列说法中错误的是
| A.a点表示的溶液中[CH3COO-]略小于10-3 mol·L-1 |
| B.b点表示的溶液中[CH3COO-]>[Na+] |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.b、d点表示的溶液中 均等于K 均等于K |
有①Na2CO3溶液②CH3COONa溶液③NaOH溶液各25 mL,物质的量浓度均为0.1 mol·L-1,下列说法正确的是
| A.3种溶液pH的大小顺序是③>②>① |
| B.若将3种溶液稀释相同倍数,pH变化最大的是② |
| C.若分别加入25 mL 0.1 mol·L-1的盐酸后,pH最大的是① |
| D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
已知常温下,浓度均为0.1 mol·L-1的4种钠盐溶液pH如下表:
| 溶质 |
Na2CO3 |
NaHCO3 |
NaClO |
NaHSO3 |
| pH |
11.6 |
9.7 |
10.3 |
5.2 |
下列说法中,正确的是
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-)