甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(1)下图是该反应在不同温度下CO的转化率随时间变化的曲线。
①该反应的焓变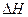 0(填“>”、“<”或“=”)。
0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1 K2(填“>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是 。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)已知在常温常压下
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) 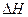 =-akJ·mol-1
=-akJ·mol-1
②2CO(g)+O2(g)=2CO2(g) 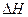 =-bkJ·mol-1
=-bkJ·mol-1
③H2O(g)=H2O(1) 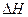 =-ckJ·mol-1
=-ckJ·mol-1
则,CH3(OH)(1)+O2(g)=CO(g)+2H2O(1) 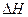 = kJ·mol-1
= kJ·mol-1
(3)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。
①该电池工作时,b口通入的物质为 ,c口通入的
物质为 。
②该电池正极的电极反应式为: 。
③工作一段时间后,当6.4g甲醇完全反应生成CO2时,
有 NA个电子转移。
(4)以上述电池做电源,用下图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):
, 。
某相对分子质量为72的烷烃。
(1)其分子式是______________;
(2)该烷烃在空气中燃烧的化学反应方程式是;
(3)它可能的结构简式是;
(1)将锌片和银片浸入稀硫酸中组成原电池,两极间连接一个电流计。锌片上发生的电极反应式为: ,银片上发生的电极反应式为: 。
(2)若该电池中两极的总质量为100g,工作一段时间后,取出锌片和银片洗干净后称量,总质量为67.5g, 则产生氢气的体积(标准状况)为 。
在一定温度下,4L密闭容器内M、N两种物质随时间变化的曲线如图所示: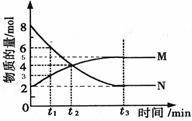
⑴由图中的数据分析,该反应的化学方程式为 。
⑵若t2 =2min,计算反应开始至t2时刻,M的平均化学反应速率为:_____。
(3)t3 min末N的正反应速率与 t3min后N的正反应速率相比(填 “大”“小”或“相等”)。
(1) 在下列化合物中:H2O2、Na2O、、I2 、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
在下列化合物中:H2O2、Na2O、、I2 、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题: 只由非金属组成的离子化合物是,
只由非金属组成的离子化合物是,
只有极性共价键的共价化合物是, 只含有非极性共价键的是,
只含有非极性共价键的是,
既有离子键又有非极性键的化合物是。
(2)在下列物质中,①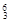 Li ②
Li ② Na ③
Na ③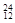 Mg ④
Mg ④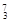 Li ⑤
Li ⑤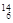 C ⑥C60⑦石墨,为同位素的是,互为同素异形体的是。(填编号)
C ⑥C60⑦石墨,为同位素的是,互为同素异形体的是。(填编号)
I.在一定条件下,反应A(气)+B(气) C(气)+Q达到平衡后,根据下列图象判断
C(气)+Q达到平衡后,根据下列图象判断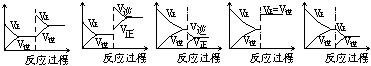
| A. | B. | C. | D. E. |
(1)升温,达到新的平衡的是 (2)降压,达到新的平衡的是
(3)减少C的量,移向新平衡的是(4)增加A的量,移向新平衡的是
(5)使用催化剂,达到平衡的是
II. CuCl2溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下
平衡:[Cu(H2O)4]2++4C1一 [CuCl4]2- +4H2O
[CuCl4]2- +4H2O
蓝色黄色
现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法
⑴⑵